
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、S2- | ||
| C. | NH4+、Mg2+、SO42-、NO3- | D. | H+、K+、Na+、Cl- |
分析 某溶液中由水电离出来的c(H+)=10-12mol/L,该溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,然后结合离子反应发生条件进行解答.
解答 解:由水电离出来的c(H+)=10-12mol/L,该溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,
A.碳酸氢根离子与氢离子、氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.硫离子与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.铵根离子、镁离子与氢氧根离子反应,在碱性溶液中不能大量共存,故C错误;
D.H+、K+、Na+、Cl-之间不发生反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
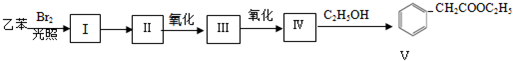
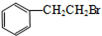 .
. .
.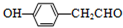 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++HCO3- | B. | NaHSO4═Na++H++SO42- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
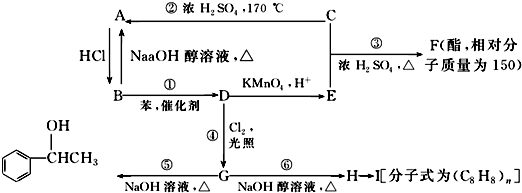
 ,E
,E .
.

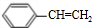 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X 元素的氢氧化物碱性弱 | |
| D. | X元素的最高化合价比Y 元素的最高化合价高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 常温下,28g C2H4含NA个碳碳双键 | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解 | |
| B. | 用灼烧的方法可以区别人造丝和蚕丝,因为蚕丝是蛋白质,被灼热时会产生具有烧焦羽毛的气味 | |
| C. | 食品添加剂虽然能改善食物的色、香、味,但由于他们对健康有害,均不宜食用 | |
| D. | 高温消毒是通过加热的方法使细菌的蛋白质变性而死亡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:| 实验序号 | 体积/mL溶液 | ||||
| K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | V1 | V3 | 4.0 | 2.0 |
| ③ | 8.0 | V2 | V4 | V5 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com