
| A. | 节约能源,提高能源利用率 | |
| B. | 大量开采化石原料,以满足社会对能源的要求 | |
| C. | 减少直至不使用对大气臭氧层起破坏作用的氟氯烃 | |
| D. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
分析 A.根据采用“绿色化学”工艺的好处判断;
B.大量开采化石原料,以满足社会对能源的需求,会增加污染物的排放量;
C.大气中的臭氧层可以吸收紫外线,对地球上的生物起保护作用,氟氯烃能破坏臭氧层;
D.节约能源,提高能源的利用率,可减少日常生活、生产实践对不可再生能源的依赖.
解答 解:A.因不可再生能源不能短期内从自然界得到补充,节约能源,提高能源的利用率,可减少日常生活、生产实践对不可再生能源如化石能源的依赖,符合善待地球、科学发展的主题,故A正确;
B.化石燃料燃烧时生成大量的二氧化碳,同时生成一氧化碳、二氧化硫等有害气体,还能产生大量的粉尘等有害颗粒物,不能为了满足能源需要,大量开采化石原料,故B错误;
C.氟利昂是臭氧层破坏的元凶,氟里昂在常温下都是无色气体或易挥发液体,略有香味,低毒,化学性质稳定,常被当作制冷剂、发泡剂和清洗剂,广泛用于家用电器,减少直至不使用对大气臭氧层起破坏作用的氟氯烃,符合善待地球、科学发展的主题,故C正确;
D.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质,是从源头消除了污染,同时在一定程度上还节约资源,故D正确.
故选B.
点评 本题考查了善待地球--科学发展相关知识,侧重考查环境的污染和原,因与生产、生活相关的知识,是高考考查的热点之一,灵活运用所学知识即可正确解答本题,本题难度不大.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | C12H22O11属于二糖 | |
| B. | 化合物X属于还原型糖 | |
| C. | 反应③中1mol化合物X分解成3mol乙醇 | |
| D. | 欲使发酵液中的酒精和水初步分离,可采取的操作是蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
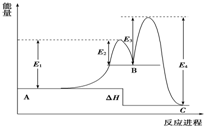 某反应由两步反应A═B═C构成,它的反应能量曲线如图(E1、E3表示活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,它的反应能量曲线如图(E1、E3表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 三种化合物中C最稳定 | ||
| C. | 加入催化剂会改变反应的焓变 | D. | 整个反应的△H=E1-E 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量 Cu(NO3)2溶液 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| C. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键、也可能是离子键 | D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入NO2,产生沉淀 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶 | |
| C. | 碳酸钙不溶于水,只有在熔融状态下才是强电解质 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电池的发明和应用是化学家们对人类社会的重要贡献之一.
电池的发明和应用是化学家们对人类社会的重要贡献之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com