
【题目】有A、B、C、D、E、F六种短周期的元素,原子序数依次增大,其中A、D元素的原子最外电子层均只有一个电子,且A是所有元素中原子半径最小的;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,F元素原子最外电子层比同周期的E元素原子的最外电子层多4个电子,E的最高价氧化物对应的水化物既能溶于强酸又能溶于强碱。请问答以下问题:
(1)写出C的元素符号_____,写出F在元素周期表中的位置_______。
(2)写出B、D、E三种元素组成的常见化合物的名称___________。
(3)写出E、F两种元素最高价氧化物对应水化物相互反应的离子方程式_______________。(4)工业生产E的化学方程式为_____________。
【答案】 F 第三周期第VIIA族 偏铝酸钠 Al(OH)3+3H+=Al3++3H2O 2Al2O3(熔融)![]() 2Al+3O2↑
2Al+3O2↑
【解析】考查元素周期表和元素周期律的应用,A和D元素的原子最外层只有1个电子,说明A和D位于IA族,A是所有元素中半径最小的,即A为H,六种元素原子序数依次增大,即D为Na,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,推出B为O,则C为F,C和F同主族,则F为Cl,F元素原子最外电子层比同周期的E元素原子的最外电子层多4个电子,E的最高价氧化物对应的水化物既能溶于强酸又能溶于强碱,推出E为Al,(1)根据上述分析,C为F,F为Cl,位于第三周期第VIIA.族;(2)B、D、E组成的化合物是NaAlO2,名称为偏铝酸钠;(3)E的最高价氧化物的水化物是Al(OH)3,F的最高价氧化物对应水化物是HClO4,两者反应的离子方程式为Al(OH)3+3H+=Al3++3H2O;(4)工业上冶炼Al,常电解熔融状态下的Al2O3,反应方程式为:2Al2O3(熔融)![]() 2Al+3O2↑。
2Al+3O2↑。


科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+H2O═H2SO4 B. NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
C. Fe+CuSO4═FeSO4+Cu D. NaOH+HNO3═NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014 Ⅱ卷】下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届福建省四地六校高三上学期12月月考】
由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )
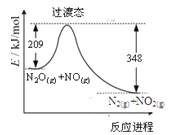
A.断键吸收能量之和大于成键释放能量之和
B.反应物总能量小于生成物总能量
C.N2O(g) +NO(g) =N2(g) +NO2(g)△H= -139kJ/mol
D.反应生成1 mol N2时转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜锌稀H2SO4构成的原电池的有关叙述错误的是( )
A. 锌为负极,锌发生氧化反应
B. 铜为正极,但铜不发生反应
C. 负极发生还原反应,正极发生氧化反应
D. 外电路电子流入的一极为正极,电子流出的一极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于三氧化硫的下列说法中,不正确的是 ( )
A. 常温下是一种易溶于水的气体
B. 能与碱反应生成硫酸盐和水
C. 能与氯化钡溶液反应产生沉淀
D. 能使石蕊试液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的物质分离与提纯的方法有过滤、分液、萃取、蒸发、蒸馏等,根据如图装置回答:
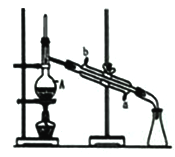
(1)仪器A的名称为______。
(2)“分离NaOH的乙醇溶液”不能用此装置的原因为_______。
(3)下列说法正确的是___________。
A.冷凝管中水流方向为a进b出
B.如果忘加沸石,可快速将沸石加入将近沸腾的液体中
C.蒸馏时可以用球型冷凝管代替直型冷凝管
D.温度计水银球位置过低,会导致收集到的产品中混有低沸点杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com