
| A、全部 | B、②③④⑤ |
| C、①②③④ | D、①③④⑤⑥ |


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
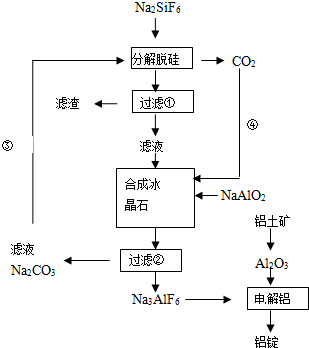
查看答案和解析>>
科目:高中化学 来源: 题型:
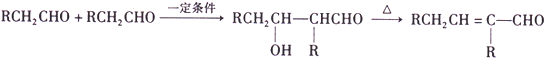
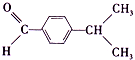 )合成兔耳草醛的路线如下:
)合成兔耳草醛的路线如下:| 丙醛 |
| 一定条件 |
| △ |
| H2 |
| Ni/△ |
| O2 |
| Cu/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
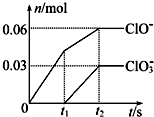 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、反应中转移电子的物质的量是0.21 mol |
| B、ClO3-的生成是由于温度升高引起的 |
| C、苛性钾溶液中KOH的质量为5.04g |
| D、反应中氧化剂和还原剂的物质的量之比为7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数(25℃) |
| HCN | K=5.0×10-10 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A、等浓度等体积的NaCN、NaHCO3溶液混合:c(Na+)+c(H+)=c(HCO3-)+c(CN-)+c(OH-)+2c(CO32-) | ||
B、若NaCN的水解平衡常数为:Kh=
| ||
| C、等浓度等体积的NaCN和NaCl溶液中离子数目前者大于后者 | ||
| D、过量CO2通入NaCN溶液中:CO2+H2O+CN-=HCO3-+HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠可以与CO2反应放出O2,可用于潜艇中的供氧剂 |
| B、硅酸钠溶液呈碱性,可涂在木材的表面作耐火剂 |
| C、SO2具有氧化性,可用于纸浆的漂白 |
| D、明矾溶于水可形成有氢氧化铝胶体,可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向海水中加碱、过滤、加酸,之后浓缩结晶、过滤、干燥、电解能得到金属镁 |
| B、将淡黄色的过氧化钠粉末加入到石蕊试液中,石蕊试液先变红后褪色 |
| C、合金性能一般优于纯金属,钢铁比纯铁具有更好的抗锈蚀能力 |
| D、将碘水倒入分液漏斗,加适量乙醇振荡后静置,可将碘萃取到乙醇中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
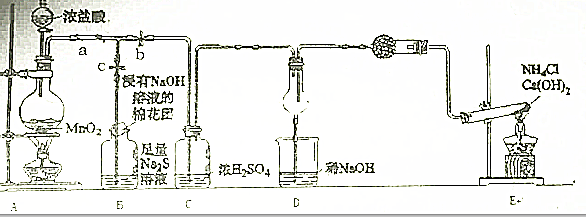
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的pH=4 |
| B、此溶液中,HA约有0.1%发生电离 |
| C、加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大 |
| D、由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com