
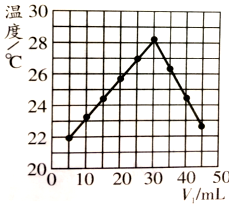
| A. | 实验操作时的环境温度为22℃ | |
| B. | 实验表明热能可转化为化学能 | |
| C. | 该实验表明有水生成的反应都是放热反应 | |
| D. | NaOH溶液的浓度约为1.50 mol/L |
分析 A.从图示观察起始温度即为实验时环境温度;
B.盐酸和氢氧化钠反应放出热量使体现温度升高;
C.根据一个反应无法得出此结论;
D.恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50Ml可知,消耗的氢氧化钠溶液的体积为20mL,以此计算NaOH浓度;
解答 解:A.从图示观察起始温度即为实验时环境温度,因此该实验开始时温度是20℃,故A错误;
B.所以由图示可以看出该反应过程放出热量,表明化学能可能转化为热能,故B错误;
C.只是该反应放热,其他有水生成的反应不一定,如氯化铵和氢氧化钡晶体的反应,故C错误;
D.恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50Ml可知,消耗的氢氧化钠溶液的体积为20mL,
恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+NaOH=NaCl+H 2O
1 1
1.0mol•L-1×0.03L n
则n=1.0mol•L-1×0.03L=0.03mol,所以浓度是:$\frac{0.03mol}{0.02L}$=1.5mol/L,故D正确;
故选:D.
点评 本题考查酸碱混合的定性判断和计算,题目难度不大,题目结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加 | |
| B. | 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态 | |
| C. | 充入SO3气体,体系压强增大,平衡向右移动 | |
| D. | 升高温度,平衡向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Cu2+、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g | B. | 64 | C. | 64 g•mol-1 | D. | 32 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平的两个托盘上各放一张大小一样的纸,然后将NaOH固体放在纸上进行称量 | |
| B. | 把称量的NaOH固体放入盛有适量蒸馏水的烧杯中,溶解后立即把溶液转移到容量瓶中 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2~3次,每次洗涤后的溶液都注入容量瓶中 | |
| D. | 沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com