



 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、SO2通入品红溶液中,溶液褪色 |
| B、新制氯水密闭放置一段时间后浅黄绿色消失 |
| C、向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
| D、向沸水中滴加适量的三氯化铁饱和溶液,溶液变为透明的红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
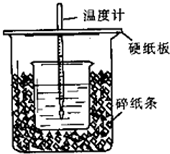 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B、加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
| C、c(Fe3+)=0.1mol?L-1的溶液:H+、Al3+、I-、SCN- |
| D、常温下pH=12的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与水反应 Cl2+H2O═2H++Cl-+ClO- | ||||
| B、氢氧化钡溶液和稀硫酸反应:Ba2++SO42-═BaSO4↓ | ||||
| C、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | ||||
D、实验室检验溶液中存在铵根离子的方程式 NH4++OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com