
 钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠,这些物质在实际生活中有广泛的应用,在一定条件下相互间能进行转化.
钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠,这些物质在实际生活中有广泛的应用,在一定条件下相互间能进行转化.分析 (1)碳酸钠溶液可与二氧化碳反应生成碳酸钠;NaHCO3不稳定,加热易分解,生成碳酸钠、水可二氧化碳,以此解答该题;
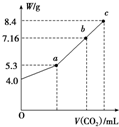
(2)由图知NaOH质量为4 g,物质的量为0.1 mol,完全转化为Na2CO3时,Na2CO3质量为0.1mol×$\frac{1}{2}$×106g/mol=5.3 g,完全转化为NaHCO3时,NaHCO3质量为0.1mol×84g/mol=8.4 g,故A点白色固体M为Na2CO3,c点白色固体M为NaHCO3,根据c=$\frac{n}{V}$计算NaOH溶液的物质的量浓度;a为碳酸钠,碳酸钠与氯化钡溶液反应生成碳酸钡沉淀;c点为碳酸氢钠,碳酸氢钠与足量氢氧化钡溶液反应生成碳酸钡沉淀和水.
解答 解:(1)向Na2CO3中通入二氧化碳,发生反应为:CO2+H2O+CO32-=2HCO3-,碳酸钠转化成碳酸氢钠,达到除杂的目的;
NaHCO3不稳定,加热易分解,则可用加热的方法除去Na2CO3固体中混有的少量NaHCO3,
故答案为:通入足量CO2;加热;
(2)由图知NaOH质量为4 g,物质的量为:$\frac{4g}{40g/mol}$=0.1 mol,完全转化为Na2CO3时,Na2CO3质量为0.1mol×$\frac{1}{2}$×106g/mol=5.3 g,完全转化为NaHCO3时,NaHCO3质量为0.1mol×84g/mol=8.4 g,故A点白色固体M为Na2CO3,c点白色固体M为NaHCO3,
①NaOH的物质的量为0.1mol,该NaOH溶液的物质的量浓度为:c(NaOH)=$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:1mol/L;
②根据分析可知,a点溶质为Na2CO3,Na2CO3与氯化钡溶液反应生成碳酸钡沉淀,反应的离子方程式为:Ba2++CO32-=BaCO3↓;
c点溶质为NaHCO3,NaHCO3与Ba(OH)2溶液反应生成碳酸钡沉淀和水,反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,
故答案为:Ba2++CO32-=BaCO3↓;HCO3-+Ba2++OH-=BaCO3↓+H2O.
点评 本题考查了物质分离与提纯、混合物反应的计算,题目难度中等,明确常见元素及其化合物性质为解答关键,(2)为难点、易错点,注意正确分析图象中曲线各点对应溶质组成,试题有利于培养学生的分析、理解能力及灵活应用能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | OF2(F显正价) | B. | CN-(N显正价) | C. | NH2-(H显正价) | D. | SiC (C显正价) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
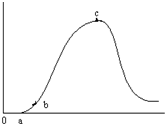 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A元素位于元素周期表的第三周期ⅢA族 | |
| B. | B的单质只能与硫酸反应,不能与氢氧化钠溶液反应 | |
| C. | C的气态氢化物的沸点比D的气态氢化物的沸点高 | |
| D. | D的非金属性比C的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
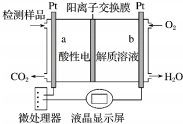
| A. | 溶液中H+从b向a定向移动 | |
| B. | a电极发生的电极反应为CH3OH-6e-+H2O=CO2↑+6H+ | |
| C. | 当电路中有1 mol e-转移时,正极区n(H+)增加1 mol | |
| D. | 将酸性电解质溶液改为碱性电解质溶液,该测试仪不可能产生电流 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 1H和2H是不同的核素,它们的质子数相等 | |
| C. | ${\;}_{90}^{230}$Th与${\;}_{90}^{232}$Th互为同素异形体 | |
| D. | ${\;}_{1}^{1}$ H、${\;}_{1}^{2}$ H、${\;}_{1}^{3}$ H、H+、H2是氢元素的五种不同粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
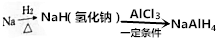 四氢铝钠(NaAlH4)在化工生产中有着重要应用.其简易合成工艺流程如图所示.
四氢铝钠(NaAlH4)在化工生产中有着重要应用.其简易合成工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3 mol H-H发生断键反应,同时2 mol N-H发生也断键反应 | |
| C. | n(N2):n(H2):n(NH3)=1:3:2 | |
| D. | 反应混合物各组分的物质的量浓度不再改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com