
| A. | 可能存在大量Ba2+ | B. | 溶液中Na+物质的量小于0.12mol | ||
| C. | 可能存在Cl- | D. | 溶液中c(Na+)≥0.6mol•L-1 |
分析 200mL溶液加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,4.66g为硫酸钡,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则原溶液中存在0.02molSO42-,碳酸钡的物质的量为$\frac{12.54g-4.66g}{197g/mol}$=0.04mol,原溶液中存在0.04molCO32-,因硫酸根离子、碳酸根离子与钡离子不能共存,一定不含Ba2+,结合电荷守恒解答即可.
解答 解:200mL溶液加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,4.66g为硫酸钡,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则原溶液中存在0.02molSO42-,碳酸钡的物质的量为$\frac{12.54g-4.66g}{197g/mol}$=0.04mol,原溶液中存在0.04molCO32-,因硫酸根离子、碳酸根离子与钡离子不能共存,一定不含Ba2+,结合电荷守恒,一定含有钠离子,氯离子是否存在无法判断.
A、一定不存在Ba2+,故A错误;
B、根据电荷守恒,假设溶液中没有氯离子,此时Na+物质的量=0.02mol×2+0.04mol×2=0.12mol,存在氯离子时,Na+物质的量大于0.12mol,故B错误;
C、溶液中氯离子是否存在无法判断,故C正确;
D、Na+物质的量n≥0.12mol,溶液中c(Na+)≥$\frac{0.12mol}{0.2L}$=0.6mol•L-1,故D正确.
故选CD.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质之间的反应、物质的性质为解答的关键,侧重分析、计算及推断能力的考查,注意离子共存及电荷守恒的应用,题目难度不大.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3mol A,2mol B | 6molA.4mol B | 2mol C |
| 达到平衡的时间/时间 | 5 | 8 | |
| A的平衡浓度/mol•L-1 | c1 | c2 | |
| C的体积分数/% | ω1 | ω2 | ω3 |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若x>4,2c1<c2 | |
| B. | 若x=4,则ω1=ω2=ω3 | |
| C. | 只有当x=4时,2ρ1=ρ2 | |
| D. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
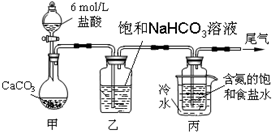
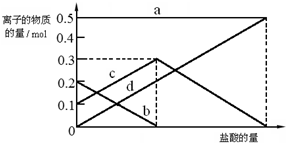
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氟化氢在所有卤化氢中热稳定性最强 | |
| B. | 浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生 | |
| C. | 100ml 0.1 mol•Lˉ1氢氟酸中,c(H+)小于0.1 mol•Lˉ1 | |
| D. | 测得常温下0.1mol•L-1NaF溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)=10-7 mol•L-1,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 氯水中含有的分子数为NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 1L 1mol•L-1的Na2CO3溶液中CO32-的数目为NA | |
| D. | 2.3 g金属钠与足量的氧气反应,无论加热与否转移电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${Fe}_{2}{O}_{3}\stackrel{HCl(aq)}{→}{FeCl}_{3}(aq)\stackrel{△}{→}{Fe(OH)}_{3}(胶体)$ | |
| B. | ${Al}_{2}{O}_{3}\stackrel{NaOH(aq)}{→}{NaAlO}_{2}(aq)\stackrel{HCl(aq)}{→}{AlCl}_{3}$ | |
| C. | ${MgCl}_{2}(aq)\stackrel{石灰乳}{→}Mg{(OH)}_{2}\stackrel{煅烧}{→}MgO$ | |
| D. | $Fe{S}_{2}\stackrel{煅烧}{→}{SO}_{3}\stackrel{{H}_{2}O}{→}{H}_{2}{SO}_{4}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com