
| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| C. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| D. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-═CO2↑+H2O |
分析 A.氢氧化钡过量,反应生成硫酸钡、氢氧化钠和水;
B.二氧化硫少量,反应生成碳酸氢钠和亚硫酸钠;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
D.不符合反应客观事实.
解答 解:A.向NaHSO4溶液中滴加过量Ba(OH)2溶液,离子方程式:H++SO42-+Ba2++OH-═BaSO4↓+H2O,故A错误;
B.用碳酸钠溶液吸收少量二氧化硫,反应生成亚硫酸钠和碳酸氢钠,反应的离子方程式为:2CO32-+SO2+H2O═2HCO3-+SO32-,故B正确;
C.少量二氧化硫通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+2HClO+Cl-,故C错误;
D.向碳酸氢钠溶液中加入氢氧化钠,离子方程式:HCO3-+OH-═CO32-+H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,为高考频考点,题目难度不大,熟悉反应的实质是解题关键,注意化学式的拆分、反应物用量对化学反应的影响,为BC易错选项.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ①③④⑦⑧ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH+H2O→CH3CHO | |
| B. | C2H5Br+H2O$\frac{\underline{\;NaOH\;}}{△}$C2H5OH+HBr | |
| C. | CaC2+2H2O→Ca(OH)2+C2H2↑ | |
| D. | CH3COOCH3+H2O$\frac{\underline{\;催化剂\;}}{△}$CH3COOH+CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 1.0 | 0 | 1.0 |
| B | 0 | 0 | 2.0 |
| C | 0.2 | 0.1 | 1.8 |
| D | 1.5 | 0.75 | 1.0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
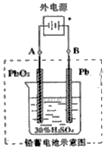 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯分子的电子式: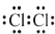 | B. | 氯离子(Cl-)的结构示意图: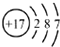 | ||
| C. | 中子数为20的氯原子: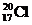 | D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏的各馏分均是纯净物 | |
| B. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| C. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| D. | 溴乙烷与NaOH水溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 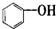 属于醇类化合物 属于醇类化合物 | B. | 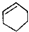 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 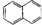 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:| 信息 | 内容 |
| ① | ClO2为黄绿色气体,极易溶于水,熔点为-59℃,沸点为11℃,具有强氧化性 |
| ② | ClO2易爆炸,若用惰性气体等稀释,则爆炸的可能性大降低 |
| ③ | HClO4、HClO2均是强酸,HClO4为无色透明液体,沸点为90℃;HClO2很不稳定,容易分解 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com