
| ��Ʒ�� | GB5461 |
| �� �� | ʳ�Ρ�����ء������ |
| 100ml |
| 25ml |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| ʱ��/min | CO2 ��mol/L�� | H2 ��mol/L�� | CO ��mol/L�� | H2O��mol/L�� |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��v��X��=0.03 mol/��L?min�� |
| B��v��Y��=0.02 mol/��L?min�� |
| C��v��Z��=0.10 mol/��L?min�� |
| D��v��w��=0.20 mol/��L?min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�




�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
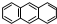 ����ʽC14H10����Ӧ����������
����ʽC14H10����Ӧ����������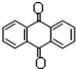 ����ʽC14H8O2������ӦʽΪ��δ��ƽ��C14H10���죩+KMnO4+H2SO4��C14H8O2��������+K2SO4+MnSO4+H2O��
����ʽC14H8O2������ӦʽΪ��δ��ƽ��C14H10���죩+KMnO4+H2SO4��C14H8O2��������+K2SO4+MnSO4+H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/0C | 250 | 310 | 350 |
| K/��mol/L��2 | 2.041 | 0.250 | 0.012 |
| Ũ��mol/L ʱ��/min | C��CO�� | C��H2�� | C��CH3OH�� |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
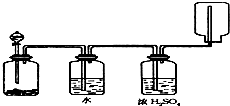 ��ͼװ�ÿ�������������ϴ�ӡ�����ռ���������β�����������壬��װ�ÿ����ڣ�������
��ͼװ�ÿ�������������ϴ�ӡ�����ռ���������β�����������壬��װ�ÿ����ڣ�������| A���������̺�˫��ˮ��Ӧ�������� |
| B��Ũ��ˮ����ʯ�һ�����ɰ��� |
| C��Na2SO3��ŨH2SO4�������SO2 |
| D��п����ϡ����������H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������£�ͭ���������ѷ�Ӧ����Ϊͭ�������ķ�Ӧ�����ȷ�Ӧ |
| B��������ڳ��ºͼ����������������Ӧ�IJ��ﲻͬ |
| C����ɫ��Ӧʵ���еIJ�˿Ӧ��ϡ����ϴ�� |
| D�������ڿ����������ۻ����������䣬˵����������û�з�����ѧ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com