
【题目】合成气(主要成分为CO、CO2和H2)是重要的化工原料,可利用合成气在催化剂存在下直接制备二甲醚(CH3OCH3)。
己知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
(1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为: 2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①要使该反应速率和产率都增大,应该采取的措施是__________,减少副反应,大幅度提高二甲醚在产物中所占比率的关键因素是__________。
②一定条件下.上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是__________(单选,填标号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 变小
变小
③在某压强下,制备二甲醚的反应在不同温度、不冋投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则05 min内的平均反应速率v(CH3OCH3)=_____________;KA、 KB、 KC三者之间的大小关系为_______________。

(2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。
①该反应的热化学方程式是_________________。
②co的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释温度低于290℃时, CO转化率较高而CH3OCH3产率较低的原因可能是___________。

(3)用甲醇,二甲醚混合液与CO在催化剂条件下还可合成醋酸。常温下,醋酸的Ka=1.8×10-5,向 0.1 mol/L 醋酸溶液中滴加NaOH溶液至 =
=![]() 时,混合溶液的pH=__________,醋酸钠水解反应的平衡常数值为__________。
时,混合溶液的pH=__________,醋酸钠水解反应的平衡常数值为__________。
【答案】 加压 催化剂 b 0.036mol·L-1·min-1 KA=KC>KB 2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g) ΔH=-204.7kJ·mol-1 CO的转化均为放热反应,温度较低时转化率较高,但CO转化为中间产物较多,转化为目标产物较少 5 5.6×10-10
【解析】(1)①已知:ⅰ、CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1=-49.0kJ·mol-1,ⅱ、2CH3OH(g)
CH3OH(g)+H2O(g)△H1=-49.0kJ·mol-1,ⅱ、2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H3=-24.5 kJ·mol-1,根据盖斯定律可知ⅰ×2+ⅱ即得到2CO2(g)+6H2(g)
CH3OCH3(g)+H2O(g)△H3=-24.5 kJ·mol-1,根据盖斯定律可知ⅰ×2+ⅱ即得到2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=-122.5 kJ·mol-1,即该反应是放热的体积减小的可逆反应,所以要使该反应速率和产率都增大,应该采取的措施是加压,减少副反应,大幅度提高二甲醚在产物中所占比率的关键因素是催化剂。②a.逆反应速率先增大后减小说明平衡向逆反应方向进行,a错误;b.H2的转化率增大说明平衡一定向正反应方向移动,b正确;c.反应物的体积百分含量减小平衡不一定向正反应方向进行,c错误;d.容器中的
CH3OCH3(g)+3H2O(g)△H=-122.5 kJ·mol-1,即该反应是放热的体积减小的可逆反应,所以要使该反应速率和产率都增大,应该采取的措施是加压,减少副反应,大幅度提高二甲醚在产物中所占比率的关键因素是催化剂。②a.逆反应速率先增大后减小说明平衡向逆反应方向进行,a错误;b.H2的转化率增大说明平衡一定向正反应方向移动,b正确;c.反应物的体积百分含量减小平衡不一定向正反应方向进行,c错误;d.容器中的![]() 变小平衡不一定向正反应方向进行,d错误,答案选b;③T1温度下,将6molCO2和12molH2充入10L的密闭容器中,根据图像可知平衡时CO2转化率是0.6,则消耗CO2是3.6mol,生成二甲醚是1.8mol,浓度是0.18mol/L,所以05 min内的平均反应速率v(CH3OCH3)=0.18mol/L÷5min=0.036mol·L-1·min-1;正反应放热,温度越低CO2转化率越高,平衡常数越大,温度是T1<T2,由于平衡常数只与温度有关系,所以KA、 KB、 KC三者之间的大小关系为KA=KC>KB。(2)①己知:ⅲ、2CO2(g)+6H2(g)
变小平衡不一定向正反应方向进行,d错误,答案选b;③T1温度下,将6molCO2和12molH2充入10L的密闭容器中,根据图像可知平衡时CO2转化率是0.6,则消耗CO2是3.6mol,生成二甲醚是1.8mol,浓度是0.18mol/L,所以05 min内的平均反应速率v(CH3OCH3)=0.18mol/L÷5min=0.036mol·L-1·min-1;正反应放热,温度越低CO2转化率越高,平衡常数越大,温度是T1<T2,由于平衡常数只与温度有关系,所以KA、 KB、 KC三者之间的大小关系为KA=KC>KB。(2)①己知:ⅲ、2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=-122.5 kJ·mol-1,ⅳ、CO2(g)+H2(g)
CH3OCH3(g)+3H2O(g)△H=-122.5 kJ·mol-1,ⅳ、CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.1 kJ·mol-1,根据盖斯定律可知ⅲ+ⅳ×2即得到热化学方程式是2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=-204.7kJ·mol-1。②由于CO的转化均为放热反应,温度较低时转化率较高,但CO转化为中间产物较多,所以转化为目标产物较少;(3)根据醋酸的电离平衡常数表达式
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1,根据盖斯定律可知ⅲ+ⅳ×2即得到热化学方程式是2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=-204.7kJ·mol-1。②由于CO的转化均为放热反应,温度较低时转化率较高,但CO转化为中间产物较多,所以转化为目标产物较少;(3)根据醋酸的电离平衡常数表达式 可知c(H+)=
可知c(H+)=  =10-5mol/L,所以混合溶液的pH=5,醋酸钠水解反应的平衡常数值为
=10-5mol/L,所以混合溶液的pH=5,醋酸钠水解反应的平衡常数值为![]() =5.6×10-10。
=5.6×10-10。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】H2CO3 和 H2C2O4 都是二元弱酸,不同 pH 环境下它们不同形态的粒子的组成百分率如图所示:

下列说法正确的是
A. 在 pH 为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-)
B. 反应 HCO3-+H2O![]() H2CO3+OH-的平衡常数为 10-7.63
H2CO3+OH-的平衡常数为 10-7.63
C. 0.1 molL-1 NaHC2O4 溶液中 c(HC2O4-)+2c(C2O42-)+c(H2C2O4) =0.1 molL-1
D. 往 Na2CO3 溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________。
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为________。
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH![]() +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O
(1)X是电池的________(填“正”或“负”,下同)极,Y是电池的________极。
(2)该电池总反应的离子方程式为:_______________________。
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。

(1)写出B、G对应的元素符号______________ 。
(2)D元素在周期表中的位置为______________。
(3)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(4)上述元素所形成的气态单质中能用于饮用水消毒的是______________(写化学式)。
(5)B的单质在F的单质中燃烧的火焰颜色为______________,所形成化合物的电子式为______________。
(6)C元素的单质可以在D和F组成的一种气态化合物中燃烧,写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
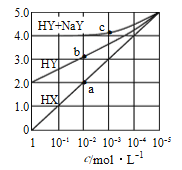
A. HX是强酸,溶液每稀释10倍,pH始终增大1
B. 常温下HY的电离常数为1.0×10-4
C. 溶液中水的电离程度:a点大于b点
D. c 点溶液中:c(Na+)>c(Y-)>c(HY)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I的分子式为C6H10O4,75%的A溶液常用于医疗消毒,与I相关的反应如下:

根据以上信息回答下列问题。
(1)写出A中所含官能团的名称_______;B的结构简式_______。
(2)写出D→E的化学方程式_______。
(3)写出F的同分异构体的结构简式(不要求环状)_______。
(4)工业上用B与O2在催化剂条件下生产环氧乙烷,写出该反应的化学方程式_______。
(5)若1molG可以和2molNaHCO3反应,则I可能的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的方法不正确的是 ( )
A. 铜粉中混有铁粉:加入过量盐酸充分反应,过滤
B. CO2中混有HCl:将其通入NaOH溶液,洗气
C. NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体
D. FeCl2溶液中混有少量FeCl3:加入Fe粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是经济增长与社会发展的重要物质基础,美国马奇蒂博士对世界一次能源替代趋势曾作如下预测:

回答下列问题:
(1)上图化石能源中属于较清洁的能源是_________
(2)核电厂的燃料一般由0.71%235U99.28%238U及0.0058%234U组成
①235U238U234U三种核素之间的关系是______________
②235g核素![]() 发生裂变反应:
发生裂变反应: ![]() ,净产生的中子
,净产生的中子![]() 数为_______
数为_______
(3)下图是氢能的制备及利用的途径之一,涉及能量转化方式有___________(填代号)

a光能→化学能 b电能→化学能 c化学能→电能
(4)目前实现煤的综合利用的主要途径是煤的干馏煤的气化和液化
①煤的干馏属于变化______________(填物理或化学)
②煤的气化过程发生的主要反应是____________
(5)可燃冰属于新能源,我国是全球第一个成功稳定开采可燃冰的国家某种可燃冰(甲烷水合物)晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,则这种可燃冰的平均组成可表示为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Ba(NO3)2和BaCl2的性质,某课外小组同学进行下列实验。
(1)甲组同学向Ba(NO3)2溶液中通入SO2,有白色沉淀生成。向BaCl2溶液中通入SO2,无明显现象。
①向Ba(NO3)2溶液中通入SO2产生的沉淀为___________(填化学式)。
②若向通入SO2的BaCl2溶液中再加入H2O2,也可产生白色沉淀,则该反应的离子方程式为________________。
(2)乙组同学向BaCl2溶液中同时通入NH3和SO2,然后滴入Na2CrO4溶液,沉淀由____(填“白色”或“黄色”,下同)转变为_____。[巳知:BaCrO4为黄色固体,Ksp(BaCrO4)sp(BaSO3)]
(3)已知25 ℃时,Ksp(BaSO3)=5.5×10-7,Ksp(BaSO4)= 1.1×10-10,则该温度下,反应:
BaSO3(s) +SO42-(aq)![]() BaSO4(s) +SO32-(aq)的平衡常数为__________。
BaSO4(s) +SO32-(aq)的平衡常数为__________。
(4)向Ba(NO3)2溶液中加入少量稀硫酸调至溶液pH为2.5,加入少量新制的纳米铁粉,充分反应后,加入NaOH溶液调至碱性,产生白色沉淀。一段时间后沉淀变为灰绿色,最后变为红褐色,将悬浊液微热,可产生使湿润的红色石蕊试纸变蓝的气体。则纳米铁粉与Ba(NO3)2酸性溶液发生的主要反应的离子方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com