
|
在含a mol Fe2(SO4)3和b mol CuSO4的混合溶液中,加入c mol Fe,充分反应后,经测定溶液中含有Fe2+和Cu2+,同时还有固体物质,则a、b、c的关系一定正确的是 | |
| [ ] | |
A. |
a <c<(a+b) |
B. |
b <c<(a+b) |
C. |
(a+c)<b |
D. |
(a+b)<c |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:江西省新余一中2012届高三第三模拟考试化学试题 题型:013
|
NA表示阿伏加德罗常数的值,下列叙述正确的是 | |
| [ ] | |
A. |
在1 L 0.2 mol·L-1的Na2CO3溶液中含有CO32-的数目为0.2NA |
B. |
0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3NA |
C. |
标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA |
D. |
15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源:广东省2009届高三化学各地名校月考试题汇编-物质的量 题型:021
|
设NA表示阿伏加德罗常数,下列说法中不正确的是 | |
A. |
一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
B. |
1 mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
C. |
0.01 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02 NA |
D. |
10 mL 5 mol/L(NH4)2SO4溶液中含有NH4+数目为0.1 NA个 |
查看答案和解析>>
科目:高中化学 来源:山西省太原市2012届高三第一学段测评考试化学试题 题型:022
如下图所示的转化关系中,已知A是由短周期元素组成的酸式盐.通常状况下,D、E、F、Y、H为气体.G和K均为常见的强酸,D和X的分子中均含有10个电子.请回答下列问题:
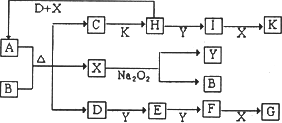
(1)B的电子式为________,其中含有的化学键类型是________;C的化学式是________.
(2)写出在加热条件下.A与足量的B溶液反应的离子方程式:________.
(3)写出D与Y在点燃条件下反应,生成X和一种单质的化学方程式:________.
(4)若G的稀溶液溶解了a mol Fe后(假设E是唯一的还原产物),溶液中两种金属阳离子的物质的量恰好相等,则被还原的G是________mol(用含a的代数式表示).
查看答案和解析>>
科目:高中化学 来源:上海市普陀区2013年高考一模化学试题 题型:038
铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子).
根据题意完成:
1、为了制备铁氧体,称取5.6 g铁粉、一定量的FeCl3(s)作为原料,先制备Fe3O4.方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1 mol Fe(OH)2与2 mol Fe(OH)3混合灼烧可得到1 mol Fe3O4].需要加入FeCl3(s)________ g.
2、如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)________ mL.
3、在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品.取a克该产品溶于100 mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体.计算:
(1)ag该产品溶于盐酸后,溶液中Fe2+的物质的量浓度(溶液体积变化忽略不计).
(2)推算该产品的化学式(写出推算过程).
4、有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+·Fe3+[Fe3+(1-x)·Cr3+x·O4].向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况).计算:(均需写出计算过程)
(1)参加反应的铁氧体的物质的量.
(2)所得气体中NO、NO2的体积比.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com