
 ;
; .
. 分析 (1)苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应;
(2)2-氯丙烷与氢氧化钠水溶液共热,发生水解反应生成2-丙醇;
(3)苯酚与浓溴水反应,是苯酚分子中羟基对苯环影响,邻对位氢原子活泼,易于被溴原子取代.
解答 解:(1)苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应,即 ,
,
故答案为: ;
;
(2)2-氯丙烷与氢氧化钠水溶液共热,发生水解反应,羟基取代氯原子,生成2-丙醇,该反应为:CH3-CHCl-CH3+NaOH$→_{△}^{H_{2}O}$CH3-CHOH-CH3+NaCl,
故答案为:CH3-CHCl-CH3+NaOH$→_{△}^{H_{2}O}$CH3-CHOH-CH3+NaCl;
(3)苯酚分子中羟基对苯环影响,邻对位氢原子活泼,易于取代,苯酚溶液中加入浓溴水,反应的化学方程式为: ,
,
故答案为: .
.
点评 本题考查有机化学反应方程式的书写,为高频考点,把握有机物的结构与性质、有机反应类型为解答的关键,侧重苯、卤代烃、苯酚性质的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
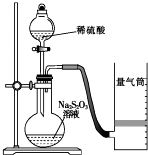 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ Na+SO42- Cl- | B. | Cu2+ Al3+ Cl-SO42- | ||
| C. | Fe2+NO3-Cl-CO32- | D. | Ag+ Na+NO3- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 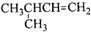 命名为3-甲基丁烯 命名为3-甲基丁烯 | |
| B. | CH3-O-CH3分子在核磁共振氢谱图中只能给出一种信号 | |
| C. | (CH3)3CCH2Cl不能发生消去反应 | |
| D. | 二氟二氯甲烷(CCl2F2)是分子是平面结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com