
下列叙述正确的是
A.在电解池的阴极和原电池的负极上都发生氧化反应
B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2
D.用惰性电极电解饱和NaCl溶液,若有lmol电子转移,则生成l molNaOH
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
①氯化铁溶液加热蒸干最终得不到氯化铁固体 ②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)  K(g)+NaCl(l)
K(g)+NaCl(l)
⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
A.②⑥ B.①②③ C.②⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法正确的是
A.若C2H6分子中含共价键数为7NA,则乙烷的体积为22.4L
B.58.5g氯化钠固体中含NaCl分子数为NA
C.78g液态苯分子中含碳碳双键数目为3NA
D.28gN2和6gH2在高温高压铁触媒催化作用下,生成的NH3分子数一定小于2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:选择题
T℃时在2L的密闭容器中X(g)与Y (g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图l所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
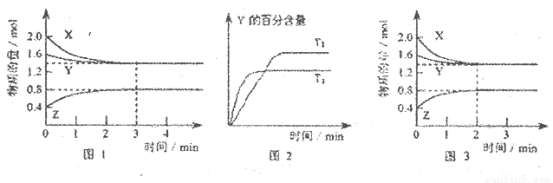
A.容器中发生的反应可表示为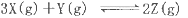
B.反应进行的前3 min内,用X表示的反应速率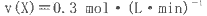
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:选择题
某课外活动小组用如图所示装置进行实验(电解液足量)。

下列说法中错误的是
A.圈l中,若开始实验时开关K与a连接,则B极的电极反应式为
B.图l中,若开始实验时开关K与b连接,则一段时间后向电解液中通入适量HCl气体可恢复到电解前的浓
C.图2中,若开始实验时开关K与a连接,则电解液的溶质质量分数变小
D.图2中,若开始实验时开关K与b连接,则A极减少
的质量等于B极增加的质量
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:实验题
(11分)某化学小组设计实验探究碳酸钠、碳酸氢钠的性质,实验如下:取两支试管分别加入10 mL相同浓度的稀盐酸,将两个各装有0 5 g的Na2CO3和NaHCO3粉末的小气球分别套在两个试管上,将气球内的固体粉末同时倒人试管中,已知盐酸足量,观察实验现象。
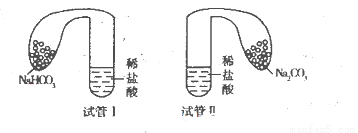
(l)两支试管中均产生气体,其中产生气体较快的为________(填“试管I”或“试管II”),投入________(填化学式)的试管中气球变得比较大。
(2)甲同学触摸上述两试管,发现试管I变冷,试管Ⅱ变热,由此提出不管其状态如何,NaHCO3与HCl反应为吸热反应,Na2CO3与HCl反应为放热反应。
为进一步探究Na2CO3、NaHCO3与盐酸反应的能量变化,乙同学进行下列实验,操作步骤为:①向试剂1中加入试剂2,搅拌、测定温度;②静置、测定温度;③再加入试剂3.搅拌、测定温度、记录。得到以下数据:
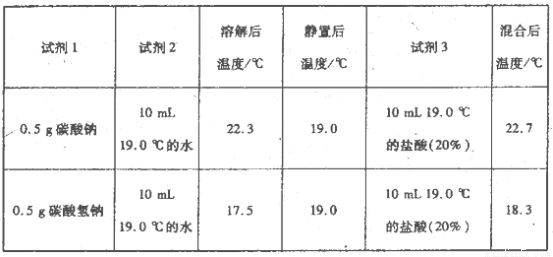
上述实验需要用到的玻璃仪器有________。
乙同学可得出结论:
①NaHCO3的溶解过程________(填“吸热”或“放热”,下同);Na2CO3的溶解过程________。
②CO32-与H+反应为一反应(填“放热”或“吸热”,下同),HCO3-与H+反应为________反应。
(3)比较甲乙同学的实验,你认为 ________(填“甲”或“乙”)的实验方案更合理、更严密。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:选择题
A、B、C、D、E为原子序数依次增大的短周期元素。已知A的一种单质是自然界中最硬的物质,B与D同主族,C与E同主族,B的一种单质能用于自来水消毒,C在元素周期表中的非金属性最强。则下列说法正确的是
A. C的最高价氧化物对应的水化物的酸性最强
B. 最简单气态氢化物的稳定性E>D>B
C.A与B形成的化合物在反应中只能作还原剂
D.A分别与其他四种元素形成的化合物一定是共价化台物
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期5月联考化学试卷(解析版) 题型:选择题
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为

下列相关说法不正确的是
A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.l mol苹果酸与足量Na反应生成33. 6 L H2
D.1 mol苹果酸能与含1molNa2CO3 的溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:填空题
(12分)(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
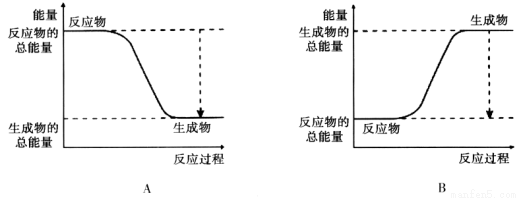
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 kJ
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com