
| A. | 稀硫酸 | B. | 碳酸氢钠溶液 | C. | 硫酸铁溶液 | D. | 氯化钠溶液 |
分析 将钠投入溶液中,钠和水反应生成氢氧化钠和氢气,氢氧化钠和酸或部分盐能发生复分解反应,根据盐的可溶性判断即可.
解答 解:A.钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸反应生成可溶性的硫酸钠和水,所以只能生成气体不会产生沉淀,故A不选;
B.钠和水反应生成可溶性的氢氧化钠和氢气,氢氧化钠和碳酸氢钠溶液反应生成碳酸钠和水,所以只能生成气体不会产生沉淀,故B不选;
C.钠和水反应生成可溶性的氢氧化钠和氢气,氢氧化钠和硫酸铁发生复分解反应生成难溶性的氢氧化铁沉淀,所以既能产生气体又能出现沉淀,故C选;
D.钠和水反应生成可溶性的氢氧化钠和氢气,所以不能产生沉淀,故D不选;
故选C.
点评 本题比较简单,钠与碱、盐的反应中首先考虑与溶液中的水反应,然后再看生成的氢氧化钠能否与碱、盐本身反应,考查了学生的思维能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
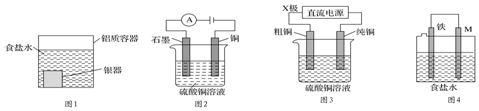
| A. | 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2-,该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| B. | 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 | |
| C. | 图3装置中若直流电源的X极为正极,则该装置可实现粗铜的电解精炼 | |
| D. | 图4装置中若M是铜,则该装置能防止铁被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
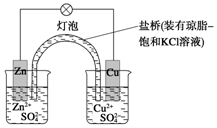 铜锌原电池(如图)工作时
铜锌原电池(如图)工作时查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 5:1 | C. | 3:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 122.5 g KClO 3中含Cl-数目为NA | |
| B. | 1 mol/L的NaOH溶液中含Na+数目为NA | |
| C. | 标准状况下,22.4 L水中含氢原子数目为2NA | |
| D. | 常温常压下,32 g S03中含氧原子数目为1.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com