
 ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.分析 (1)Fe2+、Mn2+的化合价升高,Cl元素的化合价降低;
(2)氧化还原反应,遵循电子、原子守恒;
(3)1mol Cl2参与反应时释放145kJ的热量,结合焓变、状态及物质的量与热量成正比书写;
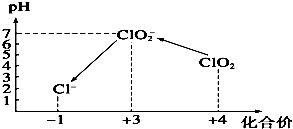
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2与淀粉结合再次出现蓝色,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
④根据关系S2O32-~I-~ClO2先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)在这个过程中,Fe2+、Mn2+的化合价升高,则ClO2的化合价降低,为氧化剂,具有氧化性,故答案为:氧化;
(2)由电子、原子守恒可知反应为2KClO3+SO2=2ClO2+K2SO4,故答案为:K2SO4;
(3)1mol Cl2参与反应时释放145kJ的热量,则热化学方程式为2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ•mol-1,
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ•mol-1;
(4)①用氢氧化钠溶液调至中性,由图可知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为2ClO2+2I-=2ClO2-+I2,
故答案为:2ClO2+2I-=2ClO2-+I2;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,
故答案为:蓝色消失,半分钟内不变色;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④结合反应可知 S2O32-~I-~ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,则ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1,
故答案为:0.675.
点评 本题考查物质含量的测定,为高频考点,把握氧化还原反应、热化学方程式、关系式、图象分析为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | K2CO3和K2O都属于钾盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2CO3都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氯气的物质的量为6a mol | |
| B. | 改变温度,产物中NaCl的最小理论产量为4a mol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol | |
| D. | 某温度下,若反应后$\frac{{c(C{l^-})}}{{c(Cl{O^-})}}$=6,则溶液中$\frac{{c(C{l^-})}}{c(ClO_3^-)}=\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素互为同分异构体,二者水解的最终产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 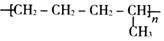 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加酚酞后溶液均变红 | |
| B. | 滴加饱和澄清石灰水均产生白色沉淀 | |
| C. | 滴加氯水均产生能使澄清石灰水变浑浊的气体 | |
| D. | 所含阳离子的总浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Cu2+、NH4+、SO42-、Cl-可以大量共存 | |
| B. | 与硝酸酸化的AgNO3溶液反应有淡黄色沉淀生成并放出气体 | |
| C. | 向含有1 mol FeBr2的溶液中通入33.6 L Cl2,反应转移电子数目为3NA | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com