
分析 ①SiO2只能与碱反应生成盐和水;MgO和Fe2O3属于碱性氧化物;
②Ⅰ.先将其溶于过量的盐酸中,滤渣为与盐酸不反应的物质;
Ⅱ.再向滤液中加入NaOH溶液至过量,氯化铝生成偏铝酸钠,滤渣为氢氧化镁和氢氧化铁;
③若将少量的蛇纹石试样直接溶于过量的NaOH溶液中,氧化铝和二氧化硅反应.
解答 解:①SiO2只能与碱反应生成盐和水,则属于酸性氧化物,MgO和Fe2O3可与酸反应生成盐和水,属于碱性氧化物,
故答案为:酸性;碱性;
②I.先将其溶于过量的盐酸中,滤渣为与盐酸不反应的物质,应为SiO2,
故答案为:SiO2;
II.加入盐酸后,滤液中含有氯化铝、氯化镁和氯化铁,再向滤液中加入NaOH溶液至过量,氯化铝生成偏铝酸钠,滤渣为氢氧化镁和氢氧化铁,
故答案为:Fe(OH)3和Mg(OH)2;
③二氧化硅和氧化铝与氢氧化钠溶液反应生成盐和水,氧化镁和氧化铁与氢氧化钠溶液不反应,所以涉及的反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;Al2O3+2NaOH=2NaAlO2+H2O.
点评 本题考查物质的分类、物质含量的测定,题目难度不大,注意掌握化学方程式的书写,知道酸性氧化物和碱性氧化物概念.


科目:高中化学 来源: 题型:解答题
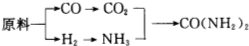
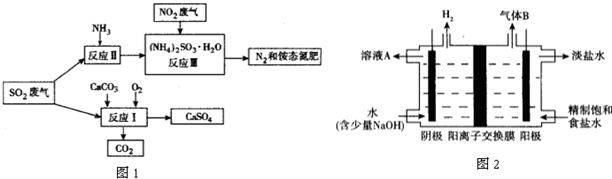
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO- | |
| B. | 0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I- | |
| C. | 0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应:H++OH-═H2O | |
| C. | 碳酸氢钠溶液与硫酸氢钠溶液反应 HCO3-+H+═CO2↑+H2O | |
| D. | 铝片插入硝酸汞溶液中:Al+Hg2+═Al3++Hg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
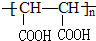 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 加热蒸干TiCl4溶液 | 产生大量固体 | 固体成分为TiCl4 |
| B | 用双氧水滴定KI淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
| C | 将K3[Fe(CN)6]溶液滴加到某溶液中 | 产生蓝色沉淀 | 该溶液中含有Fe2+ |
| D | 将SO2通入石蕊溶液中 | 溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲和乙中反应的化学平衡常数相同 | |
| B. | 乙和丙中的二氧化硫的生成速率相同 | |
| C. | 乙中SO3的体积分数大于丙 | |
| D. | 转化率:α甲(SO2)+α乙(SO3)<1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com