
����Ŀ��Ϊ̽�����������ķֽ�������������װ����ͼ��ʾ��װ��a�У���K1��K2������ͨ��N2�����ȡ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ������˵������ȷ����( )
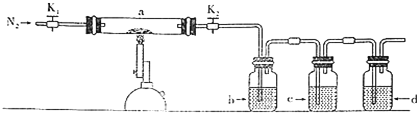
A.װ��d֮����Ҫ����β������װ��
B.װ��b�е��Լ�ΪBa(NO3)2��Һ����Ӧ���а�ɫ��������
C.װ��c�е��Լ�Ϊ����KMnO4��Һ�������dz�ȥ��������е�SO2
D.�ֽ�������������SO3��SO2��Ӧ���ȼ���SO3
���𰸡�D
��������
���������ڸ��������·ֽ������Fe2O3��SO3��SO2����Ӧ����ʽΪ��2FeSO4![]() Fe2O3+SO2��+SO3����SO3���Ȼ�����Һ��Ӧ�����BaSO4���ʿ��Ȼ�����Һ�ü���SO3���۲쵽���������а�ɫ�������ɣ�c���ڼ���SO2������Ʒ����Һ�����Ը��������Һ��dΪβ������װ�ã���������������Һ���Դ˽����⡣
Fe2O3+SO2��+SO3����SO3���Ȼ�����Һ��Ӧ�����BaSO4���ʿ��Ȼ�����Һ�ü���SO3���۲쵽���������а�ɫ�������ɣ�c���ڼ���SO2������Ʒ����Һ�����Ը��������Һ��dΪβ������װ�ã���������������Һ���Դ˽����⡣
A.dΪβ������װ�ã�����NaOH��Һ��������d����Ҫ������β������װ�ã�A����
B.bӦΪ�Ȼ��������ڼ���SO3������Ba(NO3)2��Һ��SO2�ᱻ����Ϊ���ᣬ�������ᱵ������ʵ����ۣ�B����
C.c���Լ���ΪƷ������Ը��������Һ�����ڼ���SO2�Ĵ��ڣ�C����
D.SO3����ˮ��Ӧ����H2SO4����Ӧ�ȼ���SO3�����ȼ���SO2������SO3��ˮ���������������D��ȷ��
�ʺ���ѡ����D��


 Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ������������ӵĽṹ��ͼ��ʾ�������й�˵���������( )
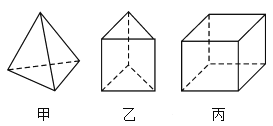
A.1 mol�����ں���10 mol���ۼ�
B.���ҷ��ӹ��ɵ����ʲ��ܷ���������Ӧ
C.�����ӵĶ���ȡ������ֻ������
D.���߲���Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Zn����Cu���õ������Ӻ���ij�������Һ�У�������ͼ��ʾװ�á��Իش��������⣺
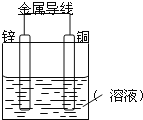
�����������ҺΪϡ���ᣬ
��1��Zn��Ϊԭ��ص�___������缫��ӦʽΪ��___��
��2��Cu��Ϊԭ��ص�___������缫��ӦʽΪ��___��
����KOH��ҺΪ�������Һ��д������ȼ�ϵ�صĵ缫��Ӧʽ
������Ӧʽ��___��
������Ӧʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͼ���пŦ�۵�أ���Zn��Ag��ʯī������Hg��Mn�ȣ�������Ƭ�л������Ĺ����������£�
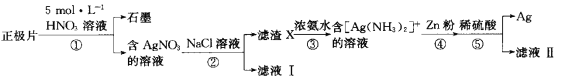
����˵��������ǣ� ��
A.���л�����Դ�������Ⱦ������
B.�۵����ӷ���ʽΪAg����2NH3��H2O =[Ag��NH3��2] ++2H2O
C.���м�ϡ�����Ŀ���dz�ȥ�����е�п
D.���������Ͼɵ�������ڱ�����������Դ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڸ������������ӹ����жϼ���Ӧ�����ӷ���ʽ����ȷ���ǣ� ��
ѡ�� | ���� | ������ | ���ӹ����жϼ���Ӧ�����ӷ���ʽ |
A | �μӰ�ˮ | Na+��Al3+��Cl-��NO3- | ���ܴ������棬Al3++3OH-=Al(OH)3�� |
B | AG=lg[ | NH4+��Fe2+��I����NO3- | һ���ܴ������� |
C | pH=1����Һ | Fe2+��Al3+�� SO42-��MnO4- | ���ܴ������棬5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | ͨ������SO2���� | K+��Na+��ClO-��SO42- | ���ܴ������棬2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5.56gFeSO4��7H2O��Ʒ������ˮ���̵��������ߣ���Ʒ�������¶ȱ仯�����ߣ���ͼ��ʾ������˵������ȷ���ǣ� ��
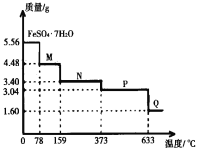
A.�¶�Ϊ78��ʱ��������M�Ļ�ѧʽΪFeSO4��4H2O
B.ȡ����380��ʱ���õ���ƷP����������������650�棬�õ�һ�ֹ�������Q��ͬʱ��������ɫ�������ɣ�Q�Ļ�ѧʽΪFe2O3
C.�ڸ������������£�N�õ�P�Ļ�ѧ����ʽΪFeSO4��H2O![]() FeSO4��H2O
FeSO4��H2O
D.�¶�Ϊ159��ʱ����N�Ļ�ѧʽΪFeSO4��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����14.2g��ˮ���������Ƴ�500 mL��Һ�������ʵ���Ũ��Ϊ______mol/L��
��2����������Һʱ������ͼ��ʾ��Ũ��_______��ƫ�ߣ�ƫ�ͣ����䣩��

��3������������Һ(��ȷ����)��ȡ��10 mL������10 mL��Һ�����ʵ���Ũ��Ϊ______mol/L�������ʵ�����Ϊ_______g��
��4����������10 mL��Һ��ˮϡ�͵�100 mL��������Һ��Na+�����ʵ���Ũ��Ϊ_________mol/L������ϡ�ͺ���Һ�е�![]() ȫ������������������Ҫ����0.1 mol/L��BaCl2��Һ___________mL��
ȫ������������������Ҫ����0.1 mol/L��BaCl2��Һ___________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͳ�������;�ܹ�����������Իش��������⣺
��1������������һ����ɫ��������д��������������H2O2�����Ȼ����������ӷ�Ӧ����ʽ��____________________________________
��2��Na2O2��K2O2�� �Լ�BaO2���������������ɹ������⣬Ŀǰʵ������ȡ���������ͨ������ij�ֹ�������������ϡ�������ã����˼����Ƶá����ʺϵĹ���������____________��д����ʽ����
������O3������ʹʪ��ĵ��ۣ��⻯����ֽ��������Ӧ�Ļ�ѧ����ʽΪ��
KI��O3��H2O��KOH��I2��O2��δ��ƽ �� �ش����⣺
�� ��ԭ����Ļ�ѧʽΪ_____________
�� ��ƽ��Ļ�ѧ����ʽ��________________________________
��4��O3 ���ɳ�����������ԭ������ͼ��ʾ�����ϡ�����Ƶá�
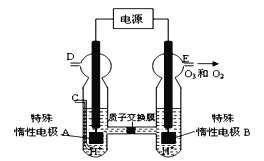
��ͼ������Ϊ_____������A������B������
�� ��C����ͨ��O 2 ��D��E���ֱ��ռ���11��2L����4��48L
���壨��״���£��� ��E���ռ���������O3��ռ���������
Ϊ__________������ O 3 �ķֽ⣩��
�� ��C��ͨ��O 2����A���ĵ缫��ӦʽΪ��____________��
��5������O3����������ȼú�����е�NOx��SO2�ѳ�Ч����������¯�����е�NOx 95����������NO��ʽ���ڵģ��ɷ�����ӦNO��g��+ O3��g��![]() NO2��g��+ O2 ��g������һ�������£���NO��O3ͨ����Ⱥ����ܱ������з���������Ӧ ������Ӧ������ʱ��仯��ʾ��ͼ������ͼ����ʾ����ͼ�ɵó�����ȷ˵����___________
NO2��g��+ O2 ��g������һ�������£���NO��O3ͨ����Ⱥ����ܱ������з���������Ӧ ������Ӧ������ʱ��仯��ʾ��ͼ������ͼ����ʾ����ͼ�ɵó�����ȷ˵����___________
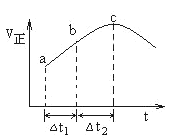
a����Ӧ��c��ﵽƽ��״̬
b����Ӧ��Ũ�ȣ�b��С��c��
c����Ӧ��������������������������
d����t1����t2ʱ��NO��ת���ʣ�a��b��С��b��c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaClO2)��Ҫ�����ġ���ֽҵ��Ư����Ҳ������ʳƷ������ˮ�����ȣ��������������ֽ⡣��������(NaClO3)��Ϊԭ���Ʊ��������ƵĹ����������£�

(1)ClO2��Cl�Ļ��ϼ�Ϊ________��
(2)����ĸҺ���л��յ���Ҫ������________(�ѧʽ)��
(3)����ȴ�ᾧ������________(���������)���ò����õ��IJ���������________��
(4)��Ӧ2��ת��0.1NA������ʱ������NaClO2������Ϊ________g��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com