
����Ŀ������1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH�������� ![]() 4Na��O2����2H2O��������������������������������������Ҳ�Ƶ��ƣ���Ӧԭ��Ϊ3Fe��4NaOH��������
4Na��O2����2H2O��������������������������������������Ҳ�Ƶ��ƣ���Ӧԭ��Ϊ3Fe��4NaOH�������� ![]() Fe3O4��2H2����4Na���������й�˵����ȷ����
Fe3O4��2H2����4Na���������й�˵����ȷ����
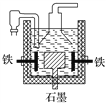
A. ������������������ƣ����������ĵ缫��ӦΪ2OH����2e��===H2����O2��
B. ���������˷�����ԭ�����������Ļ�ԭ�Ա���ǿ
C. ����ά������������˷��Ƶõ������ƣ�������Ӧ��ת�Ƶĵ�������Ҳ��ͬ
D. Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ�����������ͼ����������ʯīΪ��������Ϊ����
 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����£�����������������ȫȼ������CO2��H2O�������ĵ�O2�����ǣ� ��
A.C3H4
B.C2H4
C.CH4
D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������6��̼ԭ�ӣ���һ������һ���һ���Ϊ֧���������У� ��
A.3��
B.4��
C.5��
D.6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A��g ��+3B��g���T2C��g��+D��g������2min B��Ũ�ȼ���0.6molL��1 �� �Դ˷�Ӧ���ʵı�ʾ��ȷ���ǣ� �� ����A��ʾ�ķ�Ӧ������0.4molL��1min��1
�ڷֱ���B��C��D��ʾ�ķ�Ӧ�������ֵΪ3��2��1
����2minĩ�ķ�Ӧ���ʣ���B��ʾ��0.3molL��1min��1
������2min��B��˲ʱ����ʼ����ȣ�
A.�٢�
B.��
C.��
D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�п��ܴ��ڵ���ƽ�⡢�ε�ˮ��ƽ��ͳ������ܽ�ƽ�⡣��ش��������⣺
��1�� NaHCO3��Һ�й�����7������������Na����HCO��H����CO![]() ��H2O��________��________����д����������
��H2O��________��________�������������
��2�������£����ʵ���Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ��NH4NO3����NaCl����CH3COONa������NH4��2SO4����NaOH����Na2CO3�� pH�Ӵ�С����˳��Ϊ_________________�����������
��3������ʱ��FeCl3��ˮ��Һ��____________________________�����������������������������ԣ�ԭ�����������ӷ���ʽ��ʾ����_____________________________��ʵ����������FeCl3����Һʱ��Ϊ������FeCl3��ˮ��ɼ���������_________________________����д���ʵ�����������FeCl3��Һ�������գ����õ��Ĺ��������________��
��4�������£����ʵ���Ũ����ͬ��������Һ����NH4Cl������NH4��2SO4����NH3��H2O������NH4��2CO3����NH4HSO4����Һ��c��NH���Ӵ�С��˳��Ϊ��___________________________ �����������
��5������BaSO4�ı�����Һ�У�
�ټ���Na2SO4��Һ����c��Ba2+��__________ �����������������С����������������ͬ����
�����ļӸ���Ĺ���BaSO4����c��Ba2������________________��
����֪ij�¶�ʱ��Ksp��BaSO4����1��10��10����һ����ϡ H2SO4����һ����BaCl2 ��Һ�г�ַ�Ӧ����˳���������������100 mL��ˮ��100 mL 0��01 mol��L��1��H2SO4�ֱ�ϴ�ӣ������������ʧ��BaSO4������֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ��ⶨ���ӽṹ�ͻ�ѧ���ķ�����(����)
A.����
B.�������
C.�������
D.�˴Ź�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.�������������Ư��ֽ��
B.�ȵĴ�����Һ����ȥ�������������
C.�ƼغϽ�������Һ�壬�����ڿ����ӷ�Ӧ�ѵ��Ƚ�����
D.Ũ�����ʹ�л���̿����������������ˮ�ԣ�ʵ���ҳ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Թ��м���2-3mLҺ���ټ��ȣ���ȷ�IJ���˳���� �� ��
�ٵ�ȼ�ƾ��ƽ��м��ȣ������Թ��м���2-3mLҺ�壻
�����Թܼмг����Թܵ����ϲ����ܽ��Լ�ƿ��ƿ�ǸǺã�����ԭ����
A. �ڢۢܢ� B. �ۢڢܢ� C. �ڢܢۢ� D. �ۢڢ٢�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com