
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:2015-2016学年福建省高二上学期期中考试化学试卷(解析版) 题型:填空题
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g) + H2(g) CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
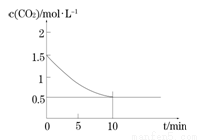
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时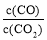 增大的是__________(填序号)。
增大的是__________(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省五校高一上第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.Cl2通入水中:Cl2+H2O═2H++Cl﹣+ClO﹣
B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I﹣═I2+2H2O
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O32﹣+4H+═SO42﹣+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中(文)化学试卷(解析版) 题型:推断题
金属铁及其化合物之间有如下的转化关系:
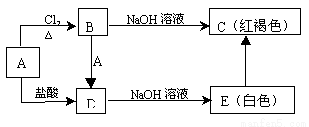
(1)请写出A、B、C的化学式: B___________ 、C__________ 、D
(2)写出铁与盐酸反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中(文)化学试卷(解析版) 题型:选择题
2022年北京-张家口第24届冬季奥林匹克运动会三大理念是“以运动员为中心、可持续发展、节俭办赛”,为了可持续发展,下列环保建议中,你认为不能采纳的是
A.用天然气代替汽油和柴油作发动机燃料
B.开发、使用新能源
C.禁止未经处理的工业废水和生活污水的任意排放
D.大量使用农药,提高粮食产量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第三次段考化学试卷(解析版) 题型:选择题
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关说法错误的是( )
A.溶液中所有离子的浓度都减小 B.CH3COOH的电离程度变大
C.水的电离程度变大 D.溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上学期期中考试化学试卷(解析版) 题型:选择题
温度为T时;向2.0 L恒容密闭容器中充入1.0 mol PCl5;反应PCl5(g) 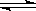 PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0. 19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B.保持其他条件不变;升高温度;平衡时c(PCl3)=0.11 mol·L-1;则反应的ΔH<0
C.相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆)
D.相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期期中考试化学试卷(解析版) 题型:填空题
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
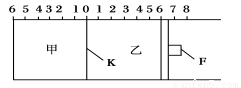
(1)达到平衡后隔板K是否可能处于0刻度_______(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(2)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为__ __mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度________处(填下列序号:①<6 ②>6 ③=6)。
(3)若一开始就将K、F固定,其他条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲________乙(填“>”、“<”或“=”);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于________。
(4)平衡后将甲容器的混合气的1.0%通入足量Ba (NO3)2溶液,生成的BaSO4质量为________g。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列化学方程式或离子方程式正确的是( )
A.FeS加入稀硫酸溶液中:FeS+2H+===Fe2++H2S↑
B.Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++HCO3-+OH-===CaCO3↓+H2O
C.铜片跟浓硝酸反应:3Cu+2NO3-+8H+===3Cu2++2NO↑+4H2O
D.酸性KMnO4溶液中滴加H2O2:2MnO4-+H2O2+6H+===2Mn2++3O2↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com