
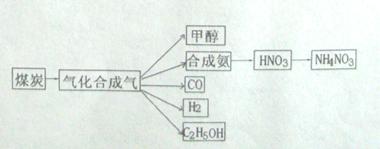
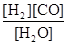 ,它所对应的化学反应为:
,它所对应的化学反应为:  2C0(g),K1 ①
2C0(g),K1 ① H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ② CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③ K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
 2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )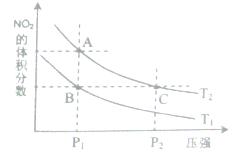
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源:不详 题型:单选题
| A.生成物浓度一定增大 | B.生成物的物质的量分数一定增大 |
| C.反应物的转化率一定增大 | D.某生成物的产率可能提高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α, 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
B.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的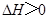 |
C.一定温度下,氯化铵水解离子方程式:NH+4+H2O NH3·H2O+H+,若用KW表示的离子积, NH3·H2O+H+,若用KW表示的离子积,Kb表示氨水电离常数,则氯化铵水解平衡常数K=KW/Kb |
| D.一种“人工固氮”的新方法是在光照条件下,N2茌催化剂表面与水蒸气发生反应生成NH3和氧气,己知: |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 K(g)+NaCl(L);
K(g)+NaCl(L);| A.①②③ | B.②④⑥ | C.③④⑤ | D.②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧
还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧 化物是NO2,碳氢化合物是CxHy
化物是NO2,碳氢化合物是CxHy ,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;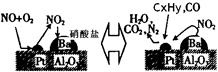
 2NO(g) K1=1×10-30 ㈠
2NO(g) K1=1×10-30 ㈠ 2H2O(g) K2=2×1081 ㈡
2H2O(g) K2=2×1081 ㈡ 2CO(g)+O2(g) K3=4×10-92 ㈢
2CO(g)+O2(g) K3=4×10-92 ㈢ ①常温下,反应2H2O(g) 2H2(g)
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K= ;
+O2(g) 平衡常数K= ;A. 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 |
| B.若升高温度,反应㈢的平衡常数K3将增大 |
| C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大 |
| D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为| A.2:1 | B.1:1 | C.2:3 | D.3:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.属于放热和熵增加的反应,就更易自发进行 |
| B.溶液在稀释过程中,溶液中的阴、阳离子浓度都减小 |
| C.对某可逆反应而言,其平衡常数K值越大,反应物的转化率也越大 |
| D.向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水中加酸,NH4+ 的浓度增大 |
| B.合成氨工业中不断从反应混合物中液化分离出氨气 |
| C.实验室中常用排饱和食盐水的方法收集Cl2 |
| D.合成氨控制在500℃左右的温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com