
| A. | 酶是具有催化功能的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或紫外线的照射会降低酶的活性 | |
| D. | 酶通常在强酸或强碱的条件下发挥作用 |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:实验题
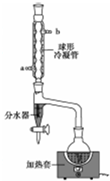 乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:
乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:| 物质名称 | 沸点/℃ | 熔点/℃ | 密度/g•cm-3 | 水中溶解度 |
| 正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
| 乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
| 乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
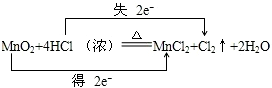 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过灼热的铁粉生成氢氧化铁和氢气 | |
| B. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| C. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| D. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
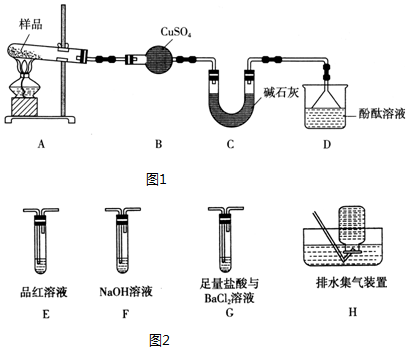
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
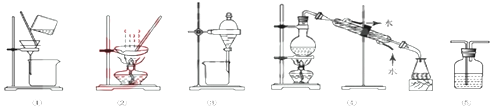
| A. | 分离Na2CO3溶液和CH3COOC2H5,选④ | B. | 粗盐提纯,选①和② | ||
| C. | 用FeC12溶液吸收C12,选⑤ | D. | 用CC14提取碘水中的碘,选③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2nmol-1 | B. | $\frac{n}{m}$mol-1 | C. | $\frac{2n}{m}$mol-1 | D. | nmol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com