
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2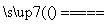
 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
A.方框中的物质应为Cu2S
B.该反应的部分产物可用于硫酸工业
C.反应中SO2既是氧化产物又是还原产物
D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移
科目:高中化学 来源: 题型:
下列两组热化学方程式中,有关ΔH的比较正确的是 )。
①CH4g)+2O2g)===CO2g)+2H2Og) ΔH1
CH4g)+2O2g)===CO2g)+2H2Ol) ΔH2
②NaOHaq)+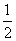 H2SO4浓)===
H2SO4浓)===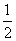 Na2SO4aq)+H2Ol) ΔH3
Na2SO4aq)+H2Ol) ΔH3
NaOHaq)+CH3COOHaq)===CH3COONaaq)+H2Ol) ΔH4
A.ΔH1>ΔH2;ΔH3>ΔH4
B.ΔH1>ΔH2;ΔH3<ΔH4
C.ΔH1=ΔH2;ΔH3<ΔH4
D.ΔH1<ΔH2;ΔH3>ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸利多卡因(F)葡萄糖注射液抗心律失常,可用于急性心肌梗死后室性早搏和室性心动过速。合成路线如下:
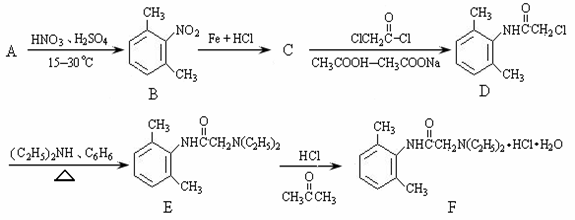
(1)B在核磁共振氢谱上有 种特征峰,D→E的反应类型是 。(每空2分)
(2)C的结构简式为 。(2分)
(3)写出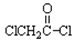 与足量的NaOH溶液共热充分反应的化学方程式:(3分)
与足量的NaOH溶液共热充分反应的化学方程式:(3分)
。
(4)B的同分异构体种类很多,符合以下条件的B的同分异构体共有 种。(3分)
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸钠溶液反应可放出CO2气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应概念正误判断,正确的打“√”,错误的打“×”
(1)有化合价升降的化学反应一定是氧化还原反应( )
(2)置换反应全部属于氧化还原反应,因为有单质参加和生成,化合价发生了变化( )
(3)氧化还原反应一定属于四大基本反应类型( )
(4)有单质参加或生成的化学反应一定是氧化还原反应( )
(5)氧化还原反应中,反应物不是氧化剂就是还原剂( )
(6)在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质( )
(7)在氧化还原反应中,非金属单质都做氧化剂( )
(8)生成物中来源于氧化剂的是还原产物( )
(9)还原剂具有还原性,反应时本身被还原,发生还原反应( )
(10)元素从化合态变为游离态,该元素不一定被还原( )
(11)失电子越多,还原性越强,得电子越多,氧化性越强( )
(12)在同一氧化还原反应中,氧化剂的氧化性一定大于氧化产物的氧化性( )
(13)金属元素被还原,不一定得到金属单质( )
(14)含氧酸的价态越高,氧化性一定越强( )
(15)不容易得到电子的物质,肯定容易失去电子( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化按氮元素只被氧化、只被还原、既不被氧化又不被还原、既可能被氧化又可能被还原的顺序排列正确的是( )
①高能固氮 ②硝酸分解 ③实验室制取氨气 ④氨氮废水脱氮(指将NH3或NH 转化为N2)
转化为N2)
A.④②③① B.②①③④
C.③④②① D.③①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为血红色,则下列叙述不正确的是( )
A.原溶液中的Br-不一定被氧化
B.通入氯气之后原溶液中的Fe2+一定被氧化
C.不能确定通入氯气之后的溶液中是否存在Fe2+
D.若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
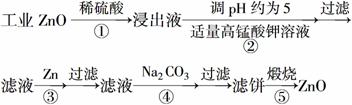
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
则:反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) 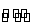 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
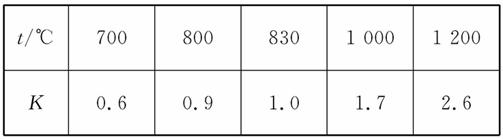
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________。
(2)能判断该反应是否达到化学平衡状态的依据是_____________________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.[CO2]=[CO]
(3)某温度下,平衡浓度符合:[CO2]·[H2]=[CO]·[H2O],试判断此时的温度为__________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
 NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,[H2]=0.5 mol·L-1,[HI]=4 mol·L-1,则此温度下反应①的平衡常数为( )
A.9 mol2·L-2 B.16 mol2·L-2 C.20 mol2·L-2 D.25 mol2·L-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com