
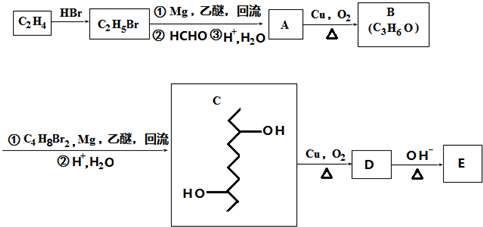
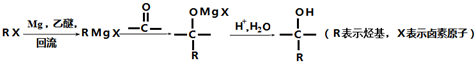

 ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式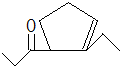 、
、 .
. 或
或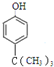
分析 根据各物质转化关系,乙烯与溴化氢加成得溴乙烷,溴乙烷与甲醛发生信息①的反应得A为CH3CH2CH2OH,A催化氧化得B为CH3CH2CHO,B发生信息①中的反应得C,C催化氧得D为 ,D发生信息②中的反应得E为
,D发生信息②中的反应得E为 ,据此答题;
,据此答题;
解答 解:根据各物质转化关系,乙烯与溴化氢加成得溴乙烷,溴乙烷与甲醛发生信息①的反应得A为CH3CH2CH2OH,A催化氧化得B为CH3CH2CHO,B发生信息①中的反应得C,C催化氧得D为 ,D发生信息②中的反应得E为
,D发生信息②中的反应得E为 ,
,
(1)B为CH3CH2CHO,B中官能团的名称为醛基,C2H4生成C2H5Br的反应类型为加成反应,
故答案为:醛基;加成反应;
(2)根据C的结构简式可知,C的分子式为 C10H22O2,
故答案为:C10H22O2;
(3)检验C2H5Br分子中含有溴原子的实验方案为取样品少量于洁净试管中,加入NaOH水溶液后加热10分钟、冷却后用稀硝酸酸化、滴入AgNO3溶液,出现淡黄色沉淀,
故答案为:取样品少量于洁净试管中,加入NaOH水溶液后加热10分钟、冷却后用稀硝酸酸化、滴入AgNO3溶液,出现淡黄色沉淀;
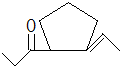
(4)D为 ,D发生信息②中的反应可以生成E为
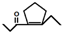
,D发生信息②中的反应可以生成E为 ,还会生成另两种具有五元环结构的副产物为
,还会生成另两种具有五元环结构的副产物为 、
、 ,
,
故答案为: 、
、 ;
;
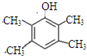
(5)E为 ,分子式为C10H16O,根据条件①分子式只比E少2个氢原子,即其分子式为C10H14O,不饱和度为4,②与FeCl3发生显色反应,说明有酚羟基,③分子中含有4种不同化学环境的氢原子,则符合条件的有机物的结构简式为
,分子式为C10H16O,根据条件①分子式只比E少2个氢原子,即其分子式为C10H14O,不饱和度为4,②与FeCl3发生显色反应,说明有酚羟基,③分子中含有4种不同化学环境的氢原子,则符合条件的有机物的结构简式为 或
或 ,
,
故答案为: 或
或 .
.
点评 本题综合考查有机物的推断,侧重于有机物的结构和官能团的性质的考查,难度中等,注意题给信息以及官能团的性质,为解答该题的关键.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | H2的燃烧热为285.8kJ/mol:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8kJ/mol | |
| D. | 碳在高温下还原二氧化硅 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
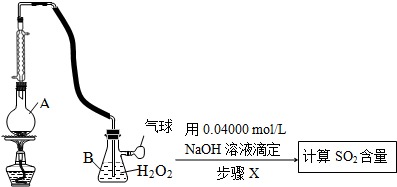
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )| A. | H2SO4浓度为4mol/L | B. | 溶液中最终溶质为FeSO4 | ||
| C. | 原混合酸中NO3-浓度为0.2mol/L | D. | AB段反应为:Fe+2Fe3+→3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
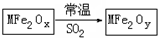 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )| A. | x<y | B. | SO2是该反应的催化剂 | ||
| C. | MFe2Ox是还原剂 | D. | 氧化性:MFe2Oy>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向两种气体中加入适量水,震荡 | B. | 将两种气体分别通入AgNO3溶液中 | ||
| C. | 用湿润的淀粉KI试纸检验 | D. | 将两种气体加压、冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
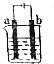 如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )
如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )| A. | H2SO4溶液 | B. | NaCl溶液 | C. | AgNO3溶液 | D. | KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粉末中一定有Na2O、Na2O2、NaHCO3 | |
| B. | 粉末中一定不含有Na2CO3和NaCl | |
| C. | 粉末中一定含有Na2O和NaHCO3 | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com