
| A. | NO2被木炭吸附 | B. | NaHSO4加热至熔化 | ||
| C. | KHSO4晶体溶于水 | D. | Na2O2溶于水 |
分析 离子化合物发生电离或发生化学反应时能破坏离子键,据此分析解答.
解答 解:A.二氧化氮中只含共价键,二氧化氮被木炭吸附属于物理变化,共价键不被破坏,故A错误;
B.硫酸氢钠加热至熔化时发生电离生成钠离子、硫酸氢根离子,所以钠离子和硫酸氢根离子之间的离子键被破坏,故B正确;
C.硫酸氢钾溶于水时电离生成钾离子、氢离子和硫酸根离子,所以离子键、共价键都被破坏,故C错误;
D.过氧化钠溶于水生成NaOH和氧气,过氧化钠中离子键和共价键、水中共价键都被破坏,且有离子键和共价键生成,故D错误;
故选B.
点评 本题考查化学键,为高频考点,明确物质构成微粒及物质发生变化实质是解本题关键,注意BC选项中电解质电离差异性,为易错点.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇的官能团是:-OH | B. | 乙醇的分子式是:CH3CH2OH | ||
| C. | 乙烯的结构简式是:CH2CH2 | D. | 乙烯无官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
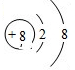 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;离子半径比较:Y离子>Z离子(填“>”或“<”).
;离子半径比较:Y离子>Z离子(填“>”或“<”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| C2H4 | C2H6 | C2H6O | C3H6 | C3H8 | C3H8O | … |
| A. | C6H14 | B. | C7H14 | C. | C7H16 | D. | C7H16O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
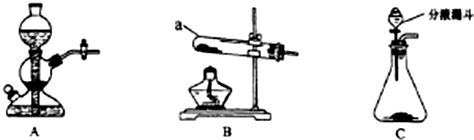
| 实验编号 药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以利用该反应检验Mn2+ | |
| B. | 配平后的系数为2、5、8、2、10、16 | |
| C. | 该反应中酸性介质不能为盐酸 | |
| D. | 若有0.1mol还原产物生成,则转移电子0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物X的键线式为:
有机物X的键线式为: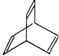
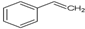
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml~120ml | B. | 100ml~120ml | C. | 110ml~130ml | D. | 100ml~130ml |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com