
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3 kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是
( )
A.焓变 B.温度
C.压强 D.熵变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
一定量的氢气在氯气中燃烧,所得的混合物用100 mL 3.00 mol·L-1 NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。求:
(1)原NaOH溶液的质量分数为___▲____。
(2)所得溶液中Cl-的物质的量为___▲____mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= ___▲____。
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
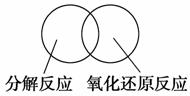
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的离子方程式否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的 离子方程式都可用“Ba2++SO
离子方程式都可用“Ba2++SO ===BaSO4↓”来表示,请写出有关反应的化学方程式(3个):
===BaSO4↓”来表示,请写出有关反应的化学方程式(3个):
①________________________________________________________;
②________________________________________________________;
③________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.“白色污染”指工厂排放的白色烟尘
B.尘埃、氮氧化合物、二氧化硫是我国城市空气污染的主要物质
C.我国沿海赤潮使大量的鱼类死亡,引起赤潮的主要原因是水的富磷化
D.含氯的塑料垃圾焚烧时会产生有毒致癌物“二 英”,“二
英”,“二 英”性质稳定,会在食物链中富集而造成食品污染
英”性质稳定,会在食物链中富集而造成食品污染
查看答案和解析>>
科目:高中化学 来源: 题型:
一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):

回答下列问题:
(1)目前工业上生产乙烯主要是以________为原料通过________反应来实现。
(2)化合物Ⅲ生成化合物Ⅳ的副产物为________。(提示:该反应的逆反应原子利用率为100%)
(3)写出合成路线中从化合物Ⅳ到化合物Ⅵ的两步反应方程式(不要求标出反应条件):________;________。
(4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是______(填字母)。
A.化合物Ⅲ可以发生氧化反应
B.化合物Ⅲ不可以与NaOH溶液反应
C.化合物Ⅳ能与氢气发生加成反应
D.化合物Ⅲ、Ⅳ和Ⅴ均可与金属钠反应生成氢气
E.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
F.化合物Ⅴ可以发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2SO2+O2 2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商)( )
2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商)( )
A.Qc不变,K变大,O2转化率增大
B.Qc不变,K变大,SO2转化率减小
C.Qc变小,K不变,O2转化率减小
D.Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.ΔH<0、ΔS>0的反应在任何温度都能自发进行
B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g)
ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【 化学一有机化学基础 】(15分)
已知:
 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):

请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是________,名称是________。
(2)G与F的相对分子质量之差为4,则G具有的性质是________(填字母)。
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是________________________,该反应类型是________反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:
_____________________、____________________。
(5)A转化为B和F的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com