
【题目】我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。 下列物品中用到硅单质的是( )
A. 陶瓷餐具 B. 石英钟表 C. 计算机芯片 D. 光导纤维
科目:高中化学 来源: 题型:
【题目】第三周期的元素单质及其化合物有广泛的用途,请根据相关知识回答下列问题:
(1)原子最外层电子数是核外电子总数![]() 的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:
![]()
在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式___________________。
(3)氯化铝的水溶液可用于净水,其原因是_________ (用离子方程式表示)。
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:
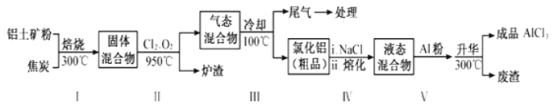
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 2980 | 3414 | 2230 |
①工业制铝时,电解Al2O3而不电解AlCl3的理由是____________。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是_________ (只要求写出一种)。
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质______________。
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为________________;其中一种盐可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________________。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见下图),下列说法正确的是( )

A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的盐类物质均可与Ca(OH)2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一。
(1)利用海水脱琉可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是___________________,氧化后的海水需要加入NaOH,与之混合后才能排放。该操作的主要目的是_________________。
(2)利用氯碱工业产品来处理含SO2的烟气的流程如图所示:

①“吸收装置”中发生反应的离子方程式_____________________。
②上述流程中循环利用的物质是____________________。
(3)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。

①通入空气吹出Br2,并用Na2CO3吸收的目的是______________________;
②反应③中每生成3molBr2,转移电子的物质的量为__________mol;
③为了除去工业Br2中微量的C12,可向工业Br2中_____________(填字母)。
a.通入HBr b.加入NaBr溶液
c.加入Na2CO3溶液 d.加入Na2SO3溶液
(4)从海水中提纯粗盐后的母液中含有K+、 Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁:
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是__________________;
②电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_____________(填字母)。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
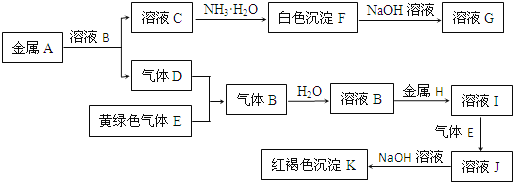
(1)写出下列物质的化学式:
A是_______________,D是___________ ,K是_______________。
(2)写出反应“C→F”的离子方程式: _______________________ 。
(3)写出反应“F→G”的化学方程式:_______________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是__________________。
(5)实验室检验溶液B中阴离子的方法是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种无色剧毒气体,沸点为-89.7℃,易自燃,与空气混合爆炸,微溶于水。其制取原理类似于实验室制氨气,现用下图装置来制取磷化氢并验证其性质。
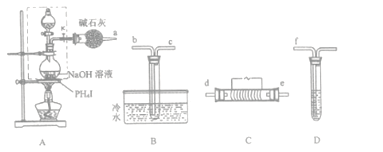
实验开始时,先从分液漏斗向盛有PH4I的圆底烧瓶中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2(SO4)3反应),微热数分钟后再从分液漏斗向圆底烧瓶中加入一定量的浓NaOH溶液继续加热。在装置C处用电热器控制温度在300℃左右,实验过程中可观察到:B装置的试管中有白色蜡状固体生成;D装置的试管中Fe2(SO4)3溶液颜色由棕黄色变成淡绿色,同时也有白色蜡状固体生成。请回答:
(1)按气流方向连接装置,从左到右的顺序为:
a→______→ → → →f
(2)检查A中虚线框内装置的气密性的方法是____
(3)用PH4I和烧碱反应制取PH3的化学方程式是_____________。
(4)实验开始时,先向圆底烧瓶中加入乙醚并微热数分钟,其目的是__________。
(5)装置C中反应的化学方程式是____________;装置D中反应的离子方程式是_____________。
(6)装置B、D中的现象说明PH3具有的化学性质是_________(填字母序号)。
A.碱性 B.不稳定性 C.还原性 D.酸性
(7)实验时处理尾气的方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com