
科目:高中化学 来源: 题型:选择题
| A. | 使用可降解塑料制品 | |
| B. | 工业废气排入大气 | |
| C. | 对化石燃料进行综合利用 | |
| D. | 尽量采取步行、骑自行车或乘坐公共交通工具等方式出行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
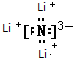 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 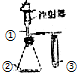 |
| A | 稀盐酸 | Na2SO4 | 溴水 | SO2具有漂白性 | |
| B | 浓氨水 | CaO | AlCl3溶液 | 白色沉淀生成后又溶解 | |
| C | 双氧水 | MnO2 | KI溶液 | 氧化性:O2>I2 | |
| D | 稀醋酸 | Na2CO3 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
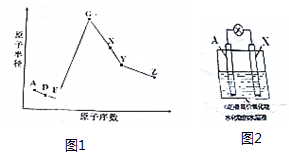
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA | |
| B. | 假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| C. | 60g冰醋酸中,所含阴、阳离子总数为2NA | |
| D. | 标准状况下,3.36L乙烷中含有的非极性键数为1.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
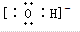 ;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com