
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)利用铬铁矿(FeO·Cr2O3)冶炼制取金属铬的工艺流程如图所示:
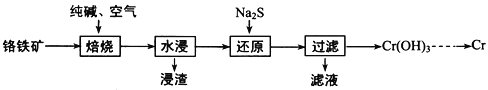
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是_________。
②“水浸”要获得浸出液的操作是________。
(2)常温下,已知Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5mol·L-1可认为完全沉淀)则Cr(OH)3的溶度积常数Ksp=___。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2![]() +2H+2
+2H+2![]() +2H2O)
+2H2O)
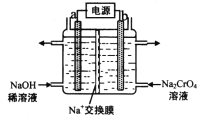
①电极b连接电源的______极(填“正”或“负),b极发生的电极反应:________
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则理论上生成重铬酸钠的物质的量是________mol(用含a、b的代数式表示)
【答案】铬铁矿粉碎 过滤 1×10-32 正 2H2O-4e-=O2↑+4H+ ![]()
【解析】
根据流程:铬铁矿(FeOCr2O3)加入纯碱、通入空气焙烧,得到Na2CrO4,过滤,滤液含有Na2CrO4,加入Na2S还原得到Cr(OH)3,反应化学方程式为:8CrO42-+3S2-+20H2O=8Cr(OH)3↓+3SO42-+16OH-,加热Cr(OH)3可得到Cr2O3,再用还原剂还原得到Cr,据此分析解答。
(1)①为加快焙烧速率和提高原料的利用率,可采取将铬铁矿粉碎,以增大表面积 ,加快焙烧速率和提高原料的利用率;答案为铬铁矿粉碎。
②根据流程,水浸得到浸渣和浸取液,分离固液的操作是过滤;答案为过滤。
(2)已知Cr3+完全沉淀时溶液pH为5,则此时c(OH-)=1×10-9mol/L,c(Cr3+)=1×10-5mol/L,Cr(OH)3的溶度积常数 Ksp=c(Cr3+)×c3(OH-)=1×10-5×(1×10-9)3=1×10-32;答案为1×10-32。
(3)①b极得到Na2Cr2O7,则b有反应2CrO42-+2H+Cr2O72-+H2O,故b的电极反应为水放电生成氧气和氢离子,反应为:2H2O-4e-=O2↑+4H+,故b极附近水失电子,发生氧化反应为阳极,连接电源正极;答案为正,2H2O-4e-=O2↑+4H+。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则溶液中移动的电荷为(a-b)mol,所以外电路中转移的电子为(a-b)mol,阳极的电极反应为:2H2O-4e-=O2+4H+,则阳极生成的氢离子为(a-b)mol,已知:2CrO42-+2H+Cr2O72-+H2O,则理论上生成重铬酸钠的物质的量是![]() mol;答案为
mol;答案为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.![]() =1012的溶液中:Fe2+、Mg2+、NO
=1012的溶液中:Fe2+、Mg2+、NO![]() 、Cl-
、Cl-
B.澄清透明的溶液中:H+、Cu2+、SO![]() 、NO
、NO![]()
C.0.1mol/L的NaHCO3溶液中:Fe3+、K+、Cl-、SO![]()
D.由水电离产生的c(H+)=1×10-12mol/L的溶液中:K+、Al3+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体锌二次电池具有电压高、成本低、安全性强和可循环使用等特点。已知:①Zn(OH)2+2OH-=Zn(OH)![]() ;②KOH凝胶中允许离子存在、生成或迁移。下列说法错误的是
;②KOH凝胶中允许离子存在、生成或迁移。下列说法错误的是
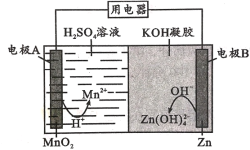
A.电池放电时,电子由电极B经导线流向电极A
B.电池反应为MnO2+ Zn + 4H++4OH-=Mn2+ + Zn(OH)![]() +2 H2 O
+2 H2 O
C.电池充电时,H+向电极A移动
D.电池充电时,电极B的质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是玻璃、制皂、造纸、纺织和漂染等工业的基本原料。
Ⅰ.世界最早工业生成纯碱的方法是路布兰(N.Leblanc)法,其流程如图:

(1)流程Ⅰ的反应是___反应(填“氧化还原”或“非氧化还原"),流程Ⅱ的反应是分步进行的,a.Na2SO4(s)与过量木炭反应生成Na2S(s);b.Na2S(s)与石灰石发生复分解反应生成Na2CO3,a步的反应化学方程式为___。
Ⅱ.19世纪60年代后生产纯碱的路布兰法被索尔维(E.Solvay)氨碱法所取代,其生产流程如图:
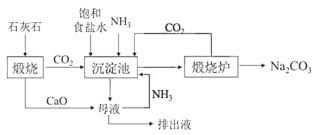
(2)氨碱法中加入NH3的主要作用是___。
(3)与路布兰法相比,氨碱法的优点有___。(写出一条即可)
Ⅲ.1939年候德榜首先提出并自行设计了联合制碱法——利用合成氨工业上的NH3和CO2和NaCl为原料生产纯碱。
(4)侯德榜制碱法的关键还在于对从反应后的混合物中分离出NaHCO3后所得溶液的处理:在溶液中加入NaCl固体并通入NH3,并在___(填温度范围)下析出NH4Cl。
表1不同温度下NaCl和NH4Cl的溶解度数据(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:![]() (橙色)+H2O2
(橙色)+H2O2![]() (黄色)+2H+,用K2Cr2O7溶液进行下列实验:
(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
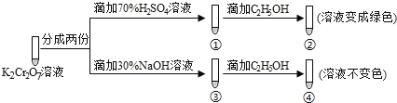
下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B.②中![]() 被C2H5OH氧化
被C2H5OH氧化
C.若向④中加入70%H2SO4溶液至过量,溶液变为绿色
D.K2Cr2O7在碱性条件下的氧化性比酸性条件更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法不正确的是
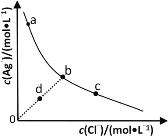
A.在AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)
B.b点的溶液中加入少量AgNO3固体,会析出白色沉淀
C.d点溶液中加入少量AgCl固体,c(Ag+)和c(Cl-)均增大
D.a、b、c三点对应的AgCl的Ksp和溶解度皆不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 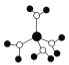 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. 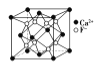 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
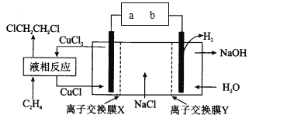
A.a为电源的负极
B.CuCl2能将C2H4还原为 l , 2-二氯乙烷
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2=CH2+ 2H2O + 2NaCl![]() H2+ 2NaOH + ClCH2CH2Cl
H2+ 2NaOH + ClCH2CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是
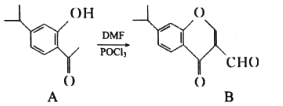
A.分子A中至少有8个碳原子位于同一平面
B.![]() 与浓溴水发生取代反应时,最多消耗
与浓溴水发生取代反应时,最多消耗![]()
C.物质B能发生银镜反应,也能发生水解反应
D.![]() 最多可与
最多可与![]() 发生加成反应
发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com