
一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入 ![]() 和
和 ![]() ,3min末测科容器内压强是起始时压强的0.9倍。在此时间内用
,3min末测科容器内压强是起始时压强的0.9倍。在此时间内用 ![]() 的量的变化来表示该反应的平均反应速率
的量的变化来表示该反应的平均反应速率 ![]() 是( )
是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| 2 | 830 | 1 | 4 | 0.8 | 0.8 | 3 |
| 3 | 830 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 起始浓度(mol. L-1) | c( NH3) | c( O2) | c( NO) | c( H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 2 | 4 | 0 | 0 |
| 丙 | 0.5 | x | y | z |
查看答案和解析>>
科目:高中化学 来源:安徽省模拟题 题型:填空题
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 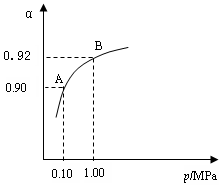
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com