
分析 (1)当升高温度时,B的转化率变大,平衡正向移动,说明正反应是吸热反应,当减小压强时,混合体系中C的质量分数减小,平衡逆向移动,则逆反应是气体体积增大的反应;
(2)若等温等积时加入B,相当增大压强,平衡正向移动;
(3)若加入催化剂,平衡不移动,平衡时气体混合物的总物质的量不变,加入少量A,A是固体物质,浓度不变,平衡不移动,则C的浓度不变;
(4)若B是有色物质,A、C均无色,而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,则B的浓度增大,颜色变深,但体积变化占主导,所以颜色变浅,则恒容下加入C,平衡向逆反应方向移动,但B的浓度增大,则颜色变深;
(5)根据平衡移动的原理分析解答.
解答 解:(1)当升高温度时,B的转化率变大,平衡正向移动,说明正反应是吸热反应,所以逆反应放热,当减小压强时,混合体系中C的质量分数减小,平衡逆向移动,则逆反应是气体体积增大的反应,则n>p,故答案为:放;>;
(2)若等温等积时加入B,相当增大压强,平衡正向移动,则是B的转化率增大,故答案为:增大;
(3)若加入催化剂,平衡不移动,平衡时气体混合物的总物质的量不变,加入少量A,A是固体物质,浓度不变,平衡不移动,则C的浓度不变,故答案为:不变;不变;
(4)若B是有色物质,A、C均无色,而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,则B的浓度增大,颜色变深,但体积变化占主导,所以颜色变浅,则恒容下加入C,平衡向逆反应方向移动,但B的浓度增大,则颜色变深,
故答案为:变浅;变深;
(5)缩小体积使体系压强由原平衡的P0变为2P0,平衡移动的结果使压强减少,但不抵消,所以压强为:P0<P<2P0,故答案为:P0<P<2P0.
点评 本题考查外界条件对平衡移动的影响,题目难度不大,注意分析反应的特征为解答该题的关键.


科目:高中化学 来源: 题型:填空题
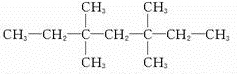
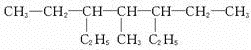
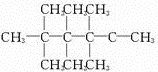
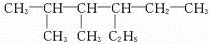
 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
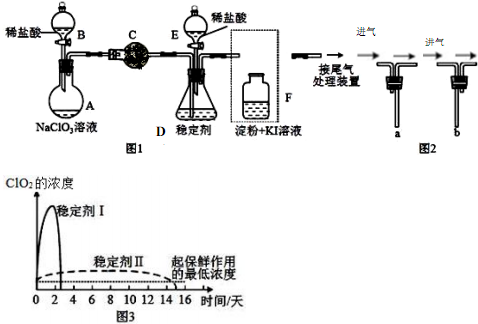
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
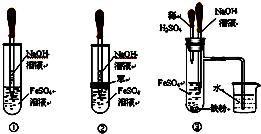
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
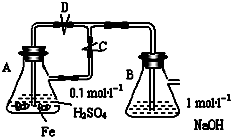
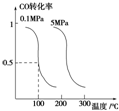 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
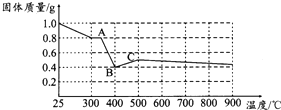 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
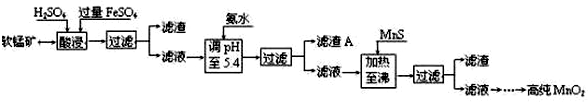
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com