
| A. | 1mol镁原子中含有的电子数为2NA | |
| B. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
分析 A、镁原子中含12个电子;
B、求出氢气的物质的量,然后根据氢气为双原子分子来分析;
C、求出二氧化硫的物质的量,然后根据二氧化硫含3个原子来分析;
D、NA个CO分子的物质的量为1mol,根据质量m=nM来分析.
解答 解:A、镁原子中含12个电子,故1mol镁原子中含12NA个电子,故A错误;
B、标况下22.4L氢气的物质的量为1mol,而氢气为双原子分子,故1mol氢气中含2NA个氢原子,故B错误;
C、64g二氧化硫的物质的量为1mol,而二氧化硫含3个原子,故1mol二氧化硫中含3NA个原子,故C正确;
D、NA个CO分子的物质的量为1mol,故质量m=nM=1mol×28g/mol=28g,故0.5mol甲烷的质量m=0.5mol×16g/mol=8g,故质量之比为7:2,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
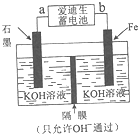 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用活性炭去除冰箱中的异味 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,反应程度越大 | B. | K越大,反应程度越小 | ||
| C. | K的大小与反应程度无关 | D. | 升高温度,K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离出钠离子与氯离子 | |
| B. | 硫酸钡难溶于水但硫酸钡属于电解质 | |
| C. | 溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 水难电离,纯水几乎不导电,所以水一定不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
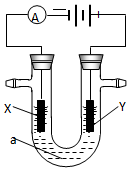 ( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:
( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
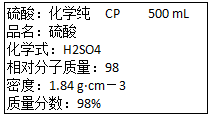 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
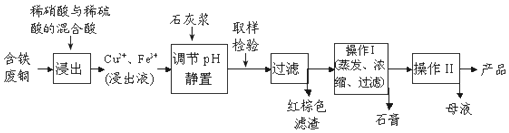
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com