
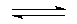
 B(OH)4-+H+;
B(OH)4-+H+;分析 (1)①氯气的氧化性强于碘,氯气能够与碘离子反应生成单质碘,碘遇到淀粉变蓝色;
②继续滴加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸;
(2)①依据氢氧化铝的酸式电离书写B(OH)3的电离方程式;
②N2H4是二元弱碱,可分别发生N2H4+H2O?N2H5++OH-、N2H5++H2O?N2H62++OH-;
(3)依据溶液中存在的电荷守恒关系判断溶液性质;
依据NH3•H2O的电离常数Kb=$\frac{c(N{H}_{4}{\;}^{+})•c(OH{\;}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,结合电离常数计算.
解答 解:(1)①氯气的氧化性强于碘,氯气能够与碘离子反应生成单质碘,离子方程式:Cl2+2I-=2Cl-+I2,碘遇到淀粉变蓝色;
故答案为:Cl2+2I-=2Cl-+I2;
②继续滴加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸,方程式为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(2)①B(OH)3是一元弱酸,电离生成B(OH)4-和H+,电离方程式:B(OH)3+H2O
故答案为:B(OH)3+H2O
②N2H4是二元弱碱,可分别发生N2H4+H2O

故答案为:N2H4+H2O

(3)将amol/L的氨水与0.01mol/L的盐酸等体积混合,溶液中存在电荷守恒:c(H+)+c(NH4+)=c(Cl-)+c(OH-),因为c(NH4+)=c(Cl-),所以c(H+)=c(OH-),所以溶液显中性;
电离常数只与温度有关,则此时NH3•H2O的电离常数Kb=$\frac{c(N{H}_{4}{\;}^{+})•c(OH{\;}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.005mol/L×1×1{0}^{-7}mol/L}{\frac{a}{2}mol/L-0.005mol/L}$=$\frac{1{0}^{-9}}{a-0.01}$mol•L-1;
故答案为:中性,$\frac{1{0}^{-9}}{a-0.01}$;
点评 本题为综合题,涉及氧化还原反应方程式的书写、弱电解质电离方程式的书写、电离平衡常数的计算,明确电离方程式书写方法、弱电解质电离常数的计算方法是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 已知2A2(g)+B2(g)?2C3(g);△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2kJ.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ +H2O△H<0
+H2O△H<0 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$ +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1的硫酸溶液进行中和热的测定,实验装置如图所示:
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1的硫酸溶液进行中和热的测定,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2发生氧化反应,HCl发生还原反应 | |
| B. | 每反应掉4mol HCl转移2 mol电子 | |
| C. | 每生成1mol Cl2转移4 mol电子 | |
| D. | 反应中锰元素将电子转移给氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | NaCl═Na++Cl NH3•H2O?NH4++OH- | 均属于电离方程式 |
| B | 向溶液中滴加盐酸酸化过的BaCl2溶液,出现白色沉淀 | 说明该溶液中一定有SO${\;}_{4}^{2-}$ |
| C | Ba2++SO${\;}_{4}^{2-}$═BaSO4↓; HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | 均可表示一类反应 |
| D | Cl2+2NaOH═NaCl+NaClO+H2O; 3S+6NaOH═2Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com