
| A. | 镁、铝分别与热水反应 | |
| B. | 镁、铝分别与盐酸反应 | |
| C. | 氯化镁溶液、氯化铝溶液分别与氢氧化钠溶液反应 | |
| D. | 将镁-铝-氢氧化钠溶液设计为原电池 |
分析 金属的金属性越强,其单质的还原性越强,其单质与水或酸反应越剧烈,其最高价氧化物的水化物碱性越强,据此判断Mg、Al的金属性强弱.
解答 解:金属的金属性越强,其单质的还原性越强,其单质与水或酸反应越剧烈,其最高价氧化物的水化物碱性越强,
A.镁、铝分别与热水反应,Mg和热水反应生成Mg(OH)2和H2,Al不反应,所以可以判断金属性强弱,故A不选;
B.Mg和盐酸反应比铝和盐酸反应剧烈,则可以比较金属性强弱,故B不选;
C.氯化镁溶液、氯化铝溶液分别与氢氧化钠溶液反应,前者生成Mg(OH)2沉淀,后者先生成沉淀后沉淀溶解,则说明氢氧化镁碱性大于氢氧化铝,所以可以比较金属性强弱,故C不选;
D.镁-铝-氢氧化钠溶液设计为原电池,该环境下Al易失电子作负极,Mg作正极,但该实验不能比较金属性强弱,故D选;
故选D.
点评 本题考查金属性强弱判断,为高频考点,明确金属性强弱判断方法是解本题关键,金属性强弱与失电子难易程度有关,与失电子多少无关,易错选项是D.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>rC)>r(B) | |
| C. | 1.0L 0.1mol/L戊溶液中含阴离子总的物质的量小于0.lmol | |
| D. | 1mol甲与足量的乙完全反应共转移约1.204×l024个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4 | |
| D. | 熔点:SiO2>NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
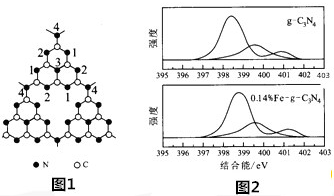 g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的密度比乙醇的大 | |
| B. | 乙醇分子中6个氢原子的化学性质完全相同 | |
| C. | 钠与乙醇的反应比钠与水的反应缓和 | |
| D. | 钠与乙醇反应产生的气体可以燃烧,燃烧前必须验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉遇到KI溶液呈现特殊蓝色 | |
| B. | 淀粉和纤维素属于多糖,其分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 多糖一般不溶于水,没有甜味,没有还原性 | |
| D. | 在稀硫酸作用下,淀粉水解生成葡萄糖和果糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/mol•L-1 | 6 | 3 | 2 | 2 |
| c(B)/mol•L-1 | 5 | 3.5 | 3 | 3 |
| c(C)/mol•L-1 | 1 | 2.5 | 3 | 3 |
| A. | 在容器中发生的反应为2A+B?2C | |
| B. | 该温度下,此反应的平衡常数为0.25 | |
| C. | A的平衡转化率比B的平衡转化率低 | |
| D. | 起始加入的A、B物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | KOH(aq)+HNO3(aq)═KNO3+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1(反应热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com