
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 向稀硝酸中加入少量铁粉 | 有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状物质 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶液X中可能含SO32-;
B.稀硝酸具有强氧化性,与铁粉反应生成的是NO气体;
C.反应生成硅酸沉淀,酸性为碳酸大于硅酸;
D.饱和碳酸钠溶液通二氧化碳,反应生成碳酸氢钠,相同条件下,碳酸氢钠的溶解度小.
解答 解:A.向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,产生白色沉淀,溶液X中可能含SO32-或SO42-,或二者均有,故A错误;
B.稀硝酸中加入少量铁粉,二者发生氧化还原反应生成NO气体,不会生成氢气,故B错误;
C.向一定浓度的Na2SiO3溶液中通入适量CO2气体,反应生成硅酸沉淀,酸性为碳酸大于硅酸,为强酸制取弱酸的反应,故C错误;
D.饱和碳酸钠溶液通二氧化碳,反应生成碳酸氢钠,相同条件下,碳酸氢钠的溶解度小,析出碳酸氢钠,则观察到溶液变浑浊,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子的检验、氧化还原反应、酸性比较及物质的性质等,侧重实验操作和实验原理的考查,注意实验方案的操作性、可行性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 质量为36.5g | |
| B. | 含有6.02×1023个HCl分子 | |
| C. | 标准状况下的体积为44.8 L | |
| D. | 溶于1L水后,溶液中H+浓度为2mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | 分子晶体熔点越高,其稳定性越增强 | |
| D. | CS2、H2O、C2H2都是直线形分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
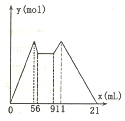 如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质
如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质| A. | 原混合液中,c(A13+):c(Mg2+):c(C1)=1:1:5 | |
| B. | 若A和B为一元强碱和一元强酸,则滴加7.5mL剂A后改滴试剂B | |
| C. | 若A是NaOH,B是盐酸,则c(NaOH):c(HC1)=2:1 | |
| D. | 从6到9,相应离子反应方程式H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反产生的气体通入溴的四氯化碳溶液 |
| B | 检验卤代烃中卤原子的种类 | 将溴乙烷与氢氧化钠溶液共热,取冷却后反应液 滴加硝酸酸化后滴加硝酸银溶液 |
| C | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| D | 验证苯和液溴在FeBr3的催化下发生取代反应 | 将反应产生的混合气体先通入溴的四氯化碳溶液再通入AgNO3溶液中,观察是否有淡黄色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 地壳中含量最多的元素 |
| Y | 元素的气态氢化物极易溶于水,水溶液遇酚酞变红 |
| Z | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒剂 |
| W | 与Z同周期,第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| R | 有多种化合价,水溶液中其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
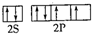 ,Z的基态原子的电子排布式为1s22s22p63s23p5.
,Z的基态原子的电子排布式为1s22s22p63s23p5.| 简单离子半径 | 第一电离能 | 电负性 | 气态氢化物稳定性 |
| X<Y | X<Y | X>Z | H2X>YH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
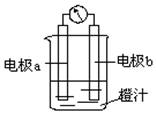 利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )| A. | a为镁条、b为锌片时,镁条为负极 | |
| B. | a为镁条、b为锌片时,橙汁中阳离子移向b电极 | |
| C. | a为锌片、b为铜片时,铜极上发生还原反应 | |
| D. | a为锌片、b为铜片时,电子由铜片通过导线流向锌片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com