
【题目】化学实验的一体化是未来化学演示实验设计的方向,它可集中解决化学实验中药品消耗量大、耗时多、污染大等系列问题。下图是二氧化硫的制备与性质的一体化实验装置图。
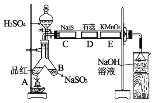
其中硫酸浓度为70%,C、D、E处分别是用Na2S溶液、紫色石蕊试液、酸性高锰酸钾溶液浸过的滤纸,按图示搭好实验装置,实验开始时由分液漏斗滴入浓硫酸即可。回答下列问题:
(1)实验室制备二氧化硫气体的化学方程式为_______。
(2)图中C、D处的实验现象分别为_______、_______。
(3)A处起始不加热,现象为_______,待全部实验结束后,用酒精灯加热,现象为_______。
(4)图中倒置漏斗的作用是_______,烧杯中NaOH溶液的作用是_______。
(5)写出E处反应的离子方程式_______。
【答案】Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ 淡黄色固体 滤纸由紫变红 品红褪色 溶液由无色变红色 防止倒吸 吸收尾气SO2,防止污染环境 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
【解析】
根据二氧化硫的实验室制法及实验装置分析解答;根据二氧化硫的漂白性和还原性分析解答。
(1)实验室用亚硫酸钠固体与一定浓度的浓硫酸反应制备SO2,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;
(2)C处SO2将-2价硫氧化为0价的硫,故有淡黄色固体生成;D处SO2的水溶液呈酸性,故滤纸由紫色变为红色;故答案为:淡黄色固体;滤纸由紫变红;
(3)SO2可使品红溶液褪色,加热后又会恢复红色;故答案为:品红褪色 ;溶液由无色变红色;
(4)因为SO2易被NaOH溶液吸收,倒置漏斗是为了防止倒吸,NaOH溶液为了吸收有毒的未反应的SO2,防止污染环境,故答案为:防止倒吸;吸收尾气SO2,防止污染环境;
(5)E中为高锰酸钾氧化二氧化硫的反应,产物为硫酸锰、硫酸钾和硫酸,根据电子守恒和电荷守恒配平写出离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】工业上常用亚硝酸钠![]() 作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备
作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备![]() 并探究NO、
并探究NO、![]() 的某一化学性质
的某一化学性质![]() 中加热装置已略去
中加热装置已略去![]() 。请回答下列问题:
。请回答下列问题:
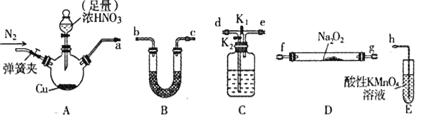
已知:①2NO+Na2O2=2NaNO2
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+
(1)装置A三颈烧瓶中发生反应的化学方程式为____________。
(2)用上图中的装置制备![]() ,其连接顺序为:
,其连接顺序为:![]() ___
___![]() ____
____![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() 按气流方向,用小写字母表示
按气流方向,用小写字母表示![]() ,此时活塞
,此时活塞![]() 、
、![]() 如何操作____________。
如何操作____________。
(3)![]() 装置发生反应的离子方程式是________________。
装置发生反应的离子方程式是________________。
(4)通过查阅资料,![]() 或NO可能与溶液中
或NO可能与溶液中![]() 发生反应。某同学选择上述装置并按
发生反应。某同学选择上述装置并按![]() 顺序连接,E中装入
顺序连接,E中装入![]() 溶液,进行如下实验探究。
溶液,进行如下实验探究。
步骤 | 操作及现象 |
① | 关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色。 |
② | 停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间 |
③ | 更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同 |
步骤②操作的目的是___________;步骤③C瓶中发生的化学方程式为_________________;通过实验可以得出:___________![]() 填“
填“![]() 、NO中的一种或两种”
、NO中的一种或两种”![]() 和溶液中
和溶液中![]() 发生反应使溶液呈深棕色。
发生反应使溶液呈深棕色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为![]() ],酸液室通入
],酸液室通入![]() (以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
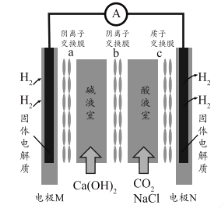
A. 电子由N极经外电路流向M极
B. N电极区的电极反应式为![]() ↑
↑
C. 在碱液室可以生成 ![]()
D. 放电一段时间后,酸液室溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成囧烷(E)的路线如下图所示:

(1)A中所含官能团的名称是_____,E的分子式为________。
(2)A→B、B→C的反应类型分别是______、_______。
(3)①在一定条件下,B与足量乙酸可发生酯化反应,其化学方程式为_______。
②C→D为醛酮缩合反应,其化学方程式为_____________________。
(4)F是一种芳香族化合物,能同时满足下列条件的F的同分异构体有__种。
①1个F分子只比1个C分子少2个氢原子
②苯环上有3个取代基
③1 mol F能与2 mol NaOH反应
写出其中核磁共振氢谱图有5组峰,且峰面积比为3∶2∶2∶2∶1的一种物质的结构简式:_______。
(5)1,2-环己二醇是一种重要的有机合成原料,请参照题中的合成路线,以 和
和![]() 为主要原料,设计合成1,2-环己二醇的合成路线(其他试剂任选)_______。
为主要原料,设计合成1,2-环己二醇的合成路线(其他试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡是世界三大饮料之一,因其含有咖啡因(结构简式为![]() )使人神经兴奋,影响人的睡眠。最近科学家用超临界二氧化碳提取咖啡因,成功制得了无因咖啡。下列说法错误的是()
)使人神经兴奋,影响人的睡眠。最近科学家用超临界二氧化碳提取咖啡因,成功制得了无因咖啡。下列说法错误的是()
A.咖啡因的化学式为C8H10N4O2
B.咖啡因是可溶于水的高分子化合物
C.咖啡因在一定条件下可与氢气发生加成反应
D.超临界二氧化碳提取咖啡因的操作是萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
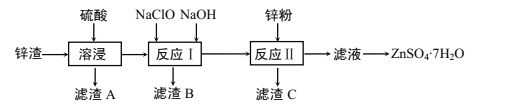
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列关于聚乙炔的叙述错误的是( )
A.聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B.聚乙炔的化学式为![]() 分子中所有碳原子不可能在同一直线上
分子中所有碳原子不可能在同一直线上
C.聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D.聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼具有高强度、高熔点、耐磨抗腐性,用于制火箭、卫星的合金构件。钼酸钠晶体(Na2MoO42H2O)是一种重要的金属缓蚀剂。利用钼矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
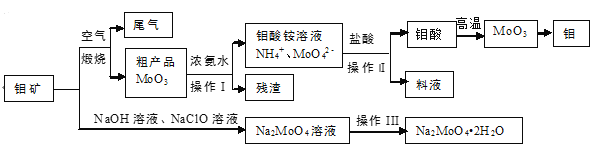
(1)Na2MoO42H2O中钼元素的价态为___,煅烧产生的尾气引起的环境危害主要是_______。
(2)用浓氨水溶解粗产品的离子方程式是_________,由图中信息可以判断MoO3是___氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作I是_____,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____。
(4)采用 NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。
①请配平以下化学反应:
___NaClO +___MoS2 + ___NaOH →___Na2MoO4 +___Na2SO4 +___NaCl +___H2O。
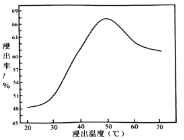
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是______(写一点)。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Lix(MoS2)n,则电池充电时阳极上的电极反应式为______。
Lix(MoS2)n,则电池充电时阳极上的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是( )
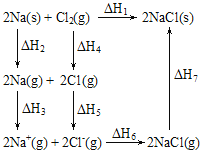
A.ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7
B.ΔH4的值数值上和Cl-Cl共价键的键能相等
C.ΔH7<0,且该过程形成了分子间作用力
D.ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com