
| 序号 | 反应 温度/℃ | c(HCl)/ mol•L-1 | v(HCl) /mL | 碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
分析 (1)实验1和实验2主要是碳酸钙的形状不同;
(2)实验2和实验4其他条件都相同,只有温度不同;
(3)试验2和实验3相比较,试验3总的盐酸浓度大,反应速率大,所用时间短.
解答 解:(1)实验1和实验2主要是碳酸钙的形状不同,则实验目的为实验1和实验2是研究碳酸钙的形状或固体形状不同,即表面积大小对化学反应速率的影响,
故答案为:固体表面积;
(2)实验2和实验4其他条件都相同,只有温度不同,故答案为:2;4;
(3)试验2和实验3相比较,试验3总的盐酸浓度大,反应速率大,所用时间短;故答案为:>.
点评 本题主要考查了影响化学反应速率的因素的探究,同学们要认真分析实验步骤设计中的对比,要前后联系,抓住要改变的条件,问题就会迎刃而解,本考点主要出现在实验题中.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
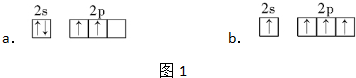
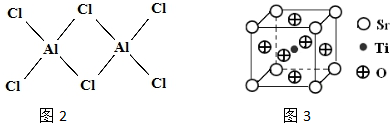
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
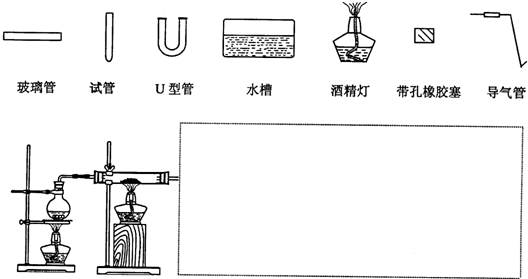
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
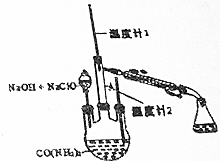 水合肼(N2H4•H2O)常用作还原剂和抗氧剂,其熔点为-40℃,沸点118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H20)涉及下列反应:
水合肼(N2H4•H2O)常用作还原剂和抗氧剂,其熔点为-40℃,沸点118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H20)涉及下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com