
分析 (1)FeSO4能电离为Fe2+和SO42-;
(2)钠在空气中燃烧生成过氧化钠;
(3)Al(OH)3溶解于NaOH溶液后生成NaAlO2和水.
解答 解:(1)FeSO4能电离为Fe2+和SO42-,故FeSO4的电离方程式为:FeSO4=Fe2++SO42-,故答案为:FeSO4=Fe2++SO42-;
(2)钠在空气中燃烧生成过氧化钠:2Na+O2$\frac{\underline{\;加热\;}}{\;}$Na2O2,故答案为:2Na+O2$\frac{\underline{\;加热\;}}{\;}$Na2O2;
(3)Al(OH)3溶解于NaOH溶液后生成NaAlO2和水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了电离方程式和化学方程式以及离子方程式的书写,难度不大,应注意的是钠燃烧生成过氧化钠.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
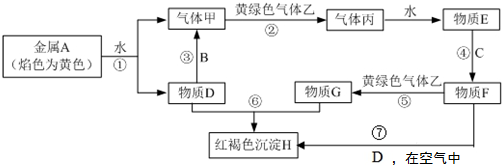
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水保存在棕色细口瓶中 | B. | NaOH保存在具有玻璃塞的细口瓶中 | ||
| C. | 金属钠保存在CCl4中 | D. | 氢氟酸保存在玻璃塞的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
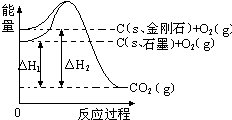 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )| A. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 石墨和金刚石是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ag+、Cl- | B. | Ba2+、H+、CO32- | C. | K+、Al3+、OH- | D. | Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脱落酸 | B. | 乙烯 | C. | 生长素 | D. | 甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
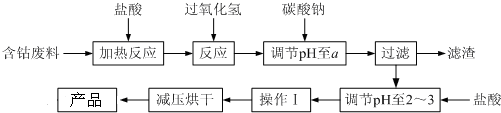
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分子代号 | 甲 | 乙 | 丙 | 丁 |
| 电子数 | 10 | 16 | 18 | 26 |
| A. | 四种气体中至少有两种气体分子互为同分异构体 | |
| B. | 四种气体通入溴的四氯化碳溶液中,都能使其褪色 | |
| C. | 气体乙的分子内所有的原子在同一平面上 | |
| D. | 鉴别丙和丁两种气体,可以用高锰酸钾酸性溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com