
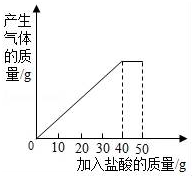
 石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
分析 (1)由图象可知,加入40g盐酸时恰好反应,每10g盐酸反应掉4g碳酸钙,故加入40g盐酸时反应掉16g碳酸钙,剩余固体的质量为4g,即为杂质的质量;
(2)由杂质的质量可知碳酸钙的质量,根据化学方程式利用碳酸钙的质量计算出氯化氢的质量,进而求质量分数.
解答 解:(1)由图象可知,加入40g盐酸时恰好反应,每10g盐酸反应掉4g碳酸钙,故加入40g盐酸时反应掉16g碳酸钙,剩余固体的质量为4g,即为杂质的质量,
故答案为:4;
(2)碳酸钙的质量为:20g-4g=16g,
设40g盐酸中氯化氢的质量为x,
CaCO3+2HC1═CaCl2+CO2↑+H2O
100 73
16g x
$\frac{100}{73}$=$\frac{16g}{x}$
x=11.68g,
所加盐酸的溶质质量分数为$\frac{11.68g}{40g}$×100%=29.2%.
答:所加盐酸的溶质质量分数为29.2%.
点评 本题考查化学反应方程式的计算,为高频考点,把握碳酸钙的质量、发生的反应、质量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 9gD2O 中含有的电子数为 5NA | |
| B. | 92gNO2和 N2O4混合气体中含有原子数为 6NA | |
| C. | 1molC3H8分子中共价键总数为 8 NA | |
| D. | 65 g Zn 全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置,过滤海带灰浸取液 | |
| B. |  用图所示装置,在滤液中通入Cl2置换I2 | |
| C. |  用图所示装置,先放出下层液体,再放出有机层 | |
| D. | 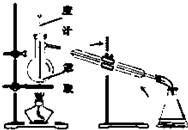 用图所示装置,回收萃取剂苯并获得单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④⑥ | C. | ②④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl、Na2CO3、Ba(NO3)2、H2SO4 | B. | BaCl2、CuSO4、NaOH、NaCl | ||
| C. | NaCl、NaOH、H2SO4、Ba(NO3)2 | D. | K2SO4、BaCl2、K2CO3、KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2 | B. | C2H6O | C. | C4H10O2 | D. | C4H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com