
 在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )
在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )| A. | 加催化剂 | B. | 降低温度 | C. | 增大NO的浓度 | D. | 缩小容器体积 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | △H3=$\frac{1}{2}$(△H1+△H2) | B. | △H3=△H2-△H1 | C. | △H3=2(△H1+△H2) | D. | △H3=$\frac{1}{2}$(△H2-△H1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3?2H++SO32- | B. | NaHSO4=Na++H++SO42- | ||
| C. | NaHCO3=Na++H++CO32- | D. | K2SO4=K2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大氧气浓度,平衡向正方向移动,K值不变 | |
| B. | 平衡时SO2气体的转化率为50% | |
| C. | 该条件下反应放出0.5QkJ的热量 | |
| D. | 降低温度,正反应速率比逆反应速率减小的程度小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
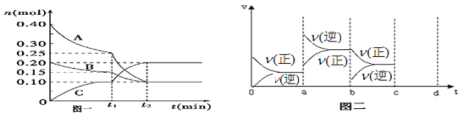
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ CO+H2 | B. | H2+CuO $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | ||
| C. | Cl2+H2O?HCl+HClO | D. | SO3+H2O═H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SO42-、Cl-、NH4+ | B. | Na+、NO3-、Ag+、CO32- | ||
| C. | Na+、Cl-、NO3-、Cu2+、 | D. | K+、HCO3-、SO42-、OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
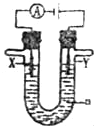 (1)CH3OH是一种可燃性的液体.已知3.2gCH3OH充分燃烧生成水蒸气时放热akJ,H2O(g)=H2O(l),△H=-bKJ•mol-1则表示CH3OH的燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-(10a+2b)kJ/mol(反应热用含a、b的代数式表示,a、b均大于0)
(1)CH3OH是一种可燃性的液体.已知3.2gCH3OH充分燃烧生成水蒸气时放热akJ,H2O(g)=H2O(l),△H=-bKJ•mol-1则表示CH3OH的燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-(10a+2b)kJ/mol(反应热用含a、b的代数式表示,a、b均大于0)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com