
| A. | 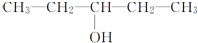 | B. | CH3-CH2-CH2-CH2OH | ||
| C. |  | D. | 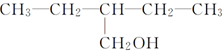 |
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 分液时,上层液体从分液漏斗下口流出 | |
| C. | 在制取蒸馏水的实验中收集冷凝水时,应弃去开始蒸馏出的部分 | |
| D. | 在制取蒸馏水的实验中,冷水从冷凝管上口入,下口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
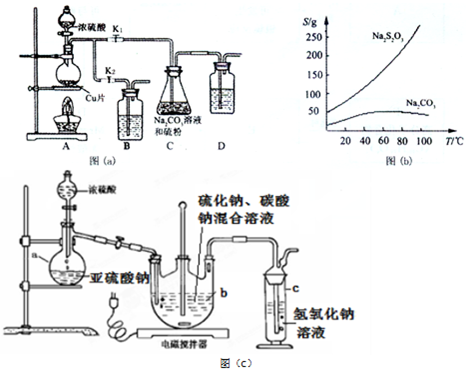
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为推广氢能的使用,工业上可采用电解水法制取大量氢气 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 将某些废旧塑料熔化后再成型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 2.5 mol•L-1 | C. | 5 mol•L-1 | D. | 2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaCl | C. | CaO | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com