
【题目】(8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_______,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)。
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
【答案】(8分)(每空1分)
(1)![]() ;(2)
;(2)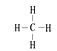 ;SiH4
;SiH4
(3)HNO3>H2CO3 (4)减小 (5)减小 (6)![]() ,离子。
,离子。
【解析】
试题分析:(1)根据元素在周期表中的位置可知⑧元素的Cl,原子核外有3个电子层,最外层有7个电子,因此该原子结构示意图为![]() 。(2)②是C元素,其气态氢化物分子CH4的结构式为
。(2)②是C元素,其气态氢化物分子CH4的结构式为 ,(3)②、③是同一周期的元素,原子序数越大,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3;(4)⑤、⑥元素是同一周期的元素,元素的原子序数越大,元素的金属性就越强,所以元素的金属性强弱顺序是依次为减小的;(5)④、⑤、⑥三种元素形成的简单离子电子层结构相同,元素的原子序数越大,离子半径就越小,离子半径依次减小。(6)①、④、⑤元素分别是H、O、Na,它们可形成既含离子键又含共价键的化合物NaOH,它的电子式是:
,(3)②、③是同一周期的元素,原子序数越大,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3;(4)⑤、⑥元素是同一周期的元素,元素的原子序数越大,元素的金属性就越强,所以元素的金属性强弱顺序是依次为减小的;(5)④、⑤、⑥三种元素形成的简单离子电子层结构相同,元素的原子序数越大,离子半径就越小,离子半径依次减小。(6)①、④、⑤元素分别是H、O、Na,它们可形成既含离子键又含共价键的化合物NaOH,它的电子式是:![]() ,形成的晶体共存微粒是阳离子、阴离子,是离子晶体。
,形成的晶体共存微粒是阳离子、阴离子,是离子晶体。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 若把H2S分子写成H3S分子,违背了共价键的饱和性
B. H3O+的存在,说明共价键没有饱和性
C. 所有的共价键都有方向性
D. 凡是有空轨道的微粒,都能接受孤电子对形成牢固的配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A. 铁轨的锈蚀 B.铁粉、生石灰用于袋装食品的防腐及防潮
C. 枪支保存时涂层黄油防锈蚀 D.消防员戴着防毒面具(内装 Na2O2)救火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应5KCl+KClO3+3H2SO4===3Cl2↑+3K2SO4+3H2O氧化生成和还原生成的氯分子数之比是
A. 1∶1 B. 5∶1
C. 1∶5 D. 3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气态烃1mol最多可与2molHCl发生加成反应,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要8mol Cl2,则该烃可能是( )
A.丙炔 B.乙炔 C.2-丁炔 D.2-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

(1)氧化过程中发生反应的离子方程式是__________________,检验氧化生成的阳离子的试剂是________________。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。

①装置c的作用是____________。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理__________,请说明理由__________(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①SO2含量的表达式是_____________(用含m、V的代数式表示)。
②从FeCl3溶液中得到FeCl3![]() 6H2O晶体的操作包括_____、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_______________。
6H2O晶体的操作包括_____、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断 Na2SeO3 的作用是
A.作氧化剂 B.作还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应可以在烃分子中引入卤素原子的是( )
A. 苯和溴水共热 B. 在光照条件下甲苯与溴的蒸气
C. 溴乙烷与NaOH水溶液共热 D. 溴乙烷与NaOH醇溶液共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
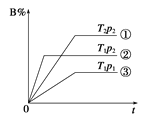
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com