
请按要求填空:
(1)用已准确称量的1.06 g Na2CO3固体配制0.100 mol·L-1Na2CO3溶液100 mL,所需要的仪器除烧杯、量筒之外,还有: 。
(2)已知KNO3、KCl的溶解度如下:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
| KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
| KCl | 31.0 | 34.0 | 37.0 | 40.0 | 42.0 | 45.5 |
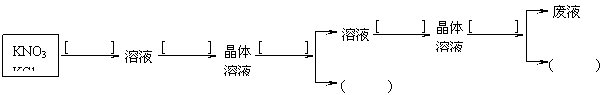 现有KNO3和KCl混合物,按如下程序分离,请在[ ]中写出分离方法,在( )中写出化合物的化学式:
现有KNO3和KCl混合物,按如下程序分离,请在[ ]中写出分离方法,在( )中写出化合物的化学式:
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

 ]2-Na+
]2-Na+ ]2-Na+
]2-Na+
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com