
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )

A.根据图1可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的 ΔH<0
2AB3(g)”的 ΔH<0
B.图2可能表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右
【答案】A
【解析】
A.升高温度,逆反应速率大于正反应速率,说明平衡向逆反应方向移动,则正反应应为放热反应,即△H<0,选项A正确;
B.从图象可知,乙曲线斜率大,乙反应到达平衡用得时间少,则乙反应速率快,根据压强对反应速率的影响,压强越大反应速率越大,则乙曲线压强大,根据反应方程式可以看出,物质D为固体,则增大压强平衡向正反应方向移动,反应物的含量减小,而图中达到平衡时反应物的浓度在两种不同压强下相同,是不符合实际的,选项B错误;
C.乙酸为弱电解质,向乙酸溶液中通入氨气,二者反应生成的醋酸铵为强电解质,溶液中离子浓度增大,导电性增强,图象不符合,选项C错误;
D. CuSO4 溶液中加入适量CuO,发生:CuO+ 2H+=Cu2+ + H2O,溶液中H+浓度减小,易于Fe3+ 水解生成沉淀,当调节pH在4左右时,Fe3+全部水解生成沉淀而除去,而加入Cu不能和H+发生反应,不能调节溶液的pH,选项D错误。
答案选A。


科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如图,下列判断不正确的是( )
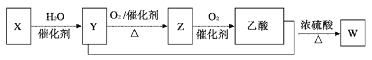
A. X可以发生加聚反应B. Y能与钠反应产生氢气
C. Z与CH3OCH3互为同分异构体D. W的结构简式为CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质 | 熔点℃ | 沸点℃ | 溶解性 |
CH3OH | -97 | 64.7 | 与水互溶 |
水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
叠氮化钠(NaN3) | 275 (410易分解) | —— | 易溶于水,微溶于醇, 不溶于乙醚 |
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。

①制取N2H4·H2O的离子方程式为_________。
②实验中通过分液漏斗滴加的溶液是_________,理由是_________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是_________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_________[实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() 。下列说法中不正确的是( )
。下列说法中不正确的是( )
A.X的分子式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C.X能使KMnO4酸性溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯化物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
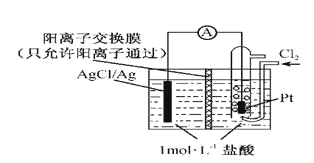
A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)![]() 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
达到平衡的时间/min | 5 | 8 | |
平衡时N2的浓度/mol·L-1 | c1 | 1.5 | |
NH3的体积分数 | ω1 | ω3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是( )
A.2c1<1.5B.ρ1=ρ2
C.ω1=2ω3D.在该温度下甲容器中反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 图甲表示可逆反应A(g)+2B(g)2C(g),速率随外界条件的改变曲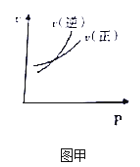
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表示用0.1mol/L NaOH溶液滴定20.00mL 0.1mol/LCH3COOH溶液得到的滴定曲线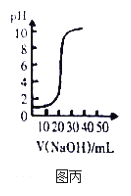
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g)相同时间后测得NO2含量的曲线,则该反应的△H<0 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数依次增大的A、B、C、D、E、F都是周期表中前四周期的元素,其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,AC2为非极性分子,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,E原子的一种核素的质量数为49,中子数为27。F元素是第四周期元素中未成对电子数最多的元素,FCl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl。请根据以上情况,回答下列问题:(答题时需用元素符号表示)
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是___________;F元素原子的最外层电子数为________个。
(2)B3-离子分别与AC2及由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为_______________;B3-离子还可以和某一价阴离子互为等电子体,该阴离子电子式为_________,这种阴离子常用于检验日常生活中的一种金属阳离子,则金属阳离子符号为_________。
(3)B元素与同周期相邻元素的第一电离能由小到大的顺序为_______________。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应中氧化剂与还原剂的物质的量之比是_______________。
(5)F3+的核外电子排布式是_________________________,FCl3形成的六配位的配合物化学式为________________________。

(6)E的一种氧化物晶胞结构(长方体)如图所示,该氧化物的化学式为__________;若该晶胞的三个晶胞参数分别为:apm、bpm、cpm。则该氧化物的密度为____________g/cm3。(写出表达式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com