
向100mL 0.1mol•L﹣1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L﹣1 Ba(OH)2溶液. 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
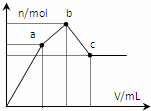
A. a点对应的沉淀只有BaSO4
B. c点溶液呈碱性
C. b点发生反应的离子方程式是:Al3++2SO42﹣+2Ba2++3OH﹣═Al(OH)3↓+2BaSO4↓
D. c点加入Ba(OH)2溶液的体积为200mL
考点: 镁、铝的重要化合物.
专题: 图示题.
分析: 100mL 0.1mol•L﹣1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42﹣0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42﹣+Ba2+=BaSO4↓,Al3++3OH﹣=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH﹣,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42﹣未完全沉淀,此时溶液含有硫酸铵(开始到a);再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42﹣+Ba2+=BaSO4↓,NH4++OH﹣=NH3·H2O,所以沉淀质量继续增加;当SO42﹣完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH﹣,Al3+反应掉0.03molOH﹣,生成Al(OH)30.01mol,剩余0.01molOH﹣恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液(a到b);继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH﹣=AlO2﹣+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c).
解答: 解:100mL 0.1mol•L﹣1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42﹣0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42﹣+Ba2+=BaSO4↓,Al3++3OH﹣=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH﹣,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42﹣未完全沉淀,此时溶液含有硫酸铵;再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42﹣+Ba2+=BaSO4↓,NH4++OH﹣=NH3·H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42﹣完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH﹣,Al3+反应掉0.03molOH﹣,生成Al(OH)30.01mol,剩余0.01molOH﹣恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH﹣=AlO2﹣+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.
A、由分析可知,从开始到a点,发生反应为SO42﹣+Ba2+=BaSO4↓,Al3++3OH﹣=Al(OH)3↓,a点对应的沉淀为BaSO4和
Al(OH)3,故A错误;
B、由分析可知,c为溶液为氨水与偏铝酸钡溶液,所以溶液呈碱性,故B正确;
C、由分析可知,b点发生反应为SO42﹣+Ba2+=BaSO4↓,NH4++OH﹣=NH3·H2O,故C错误;
D、由分析可知,c点加入Ba(OH)2的物质的量为0.005mol+0.02mol=0.025mol,所以 =0.25L=250ml,故D错误.
=0.25L=250ml,故D错误.
故选:B.
点评: 考查铝化合物的性质及计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH﹣首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH﹣首先与NH4+反应.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透.遇到难溶的ZnS或PbS慢慢转变为铜蓝(CuS).下列分析正确的是( )
|
| A. | 相同温度下,CuS的溶解度大于PbS的溶解度 |
|
| B. | 原生铜的硫化物具有还原性,而铜蓝没有还原性 |
|
| C. | CuSO4与ZnS反应的离子方程式是Cu2++S2﹣=CuS↓ |
|
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷.下列说法不正确的是( )
A. “两者同食”发生的反应中维生素C作还原剂
B. 五价砷在维生素C作用下发生了还原反应
C. 河虾中含有的五价砷,没有毒性
D. 可以推测砒霜中所含的砷元素化合价为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A. 1:9 B. 1:7 C. 1:5 D. 2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列物质的溶液中,加入CaCl2溶液不产生沉淀,再加入NaOH溶液才产生沉淀的是( )
A. Na2CO3 B. AgNO3 C. NaHCO3 D. KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g.请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 .
(2)试通过计算确定该结晶水合物的化学式.
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol•L﹣1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
查看答案和解析>>
科目:高中化学 来源: 题型:
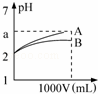
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
①a=5时,A是强酸,B是弱酸;
②若A、B都是弱酸,则5>a>2;
③稀释后,A酸溶液的酸性比B酸溶液强;
④A、B两种酸溶液的物质的量浓度一定相等.
|
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A. 16g B. 32g C. 64g/mol D. 32g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com