
| 1 |
| 2 |
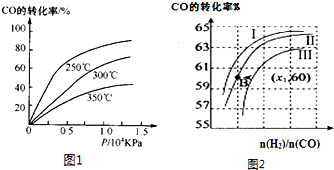
| n(H2) |
| n(CO) |
| 1 |
| 2 |
| 1 |
| 3 |
| ||||
(1-
|


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
| A、放热反应不需加热即可发生 |
| B、化学反应均伴随有能量变化,这种能量变化除热能外,还可以是光能、电能等 |
| C、可燃物的燃烧热的大小与参与反应的可燃物的多少无关 |
| D、化学反应热效应数值与参与反应的物质多少有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| B、为降低铜锌原电池中的极化作用,可在电解质溶液中加入少量双氧水 |
| C、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加2mL的水,以防过滤时硝酸钾晶体过早析出 |
| D、为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 酚酞,别名非诺夫他林,是制药工业原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型,其结构如右图所示,有关酚酞说法不正确的是( )
酚酞,别名非诺夫他林,是制药工业原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型,其结构如右图所示,有关酚酞说法不正确的是( )| A、分子式为C20H14O4 |
| B、可以发生取代反应、加成反应、氧化反应 |
| C、含有的官能团有羟基、酯基 |
| D、1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 |
| B、有机物D分子中所有碳原子一定共面 |
| C、有机物C 的所有同分异构体中不可有芳香族化合物存在 |
| D、有机物B 既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、从a点到b点,混合溶液不可能存在:c(Cl-)=c(NH4+) |
| B、由水电离的c(H+):b点>c点 |
| C、氨水的电离平衡常数:b点>a点 |
| D、b焦到c点,混合溶液中可能存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com