
分析 放电时,PbO2中铅的化合价降低,说明PbO2在正极得到电子发生还原反应生成硫酸铅;负极发生氧化反应,Pb失去电子生成PbSO4,负极增重质量为生成PbSO4中的硫酸根离子的质量,根据电子转移守恒计算.
解答 解:放电时,PbO2中铅的化合价降低,说明PbO2在正极得到电子发生还原反应生成硫酸铅,电极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;放电时,负极发生氧化反应,Pb失去电子生成PbSO4,负极电极反应式为:Pb+SO42--2e-=PbSO4,则负极增重质量为负极生成PbSO4中硫酸根离子的质量,
负极参加反应硫酸根为:$\frac{96g}{96g/mol}$=1mol,则外电路通过电子数目是2NA,
故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;2NA.
点评 本题以铅蓄电池为载体,考查原电池工作原理,关键是明确电极反应式的书写,注意电解质溶液参加反应,难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
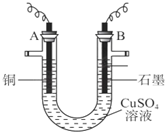
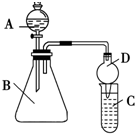 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
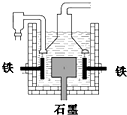 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不相同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
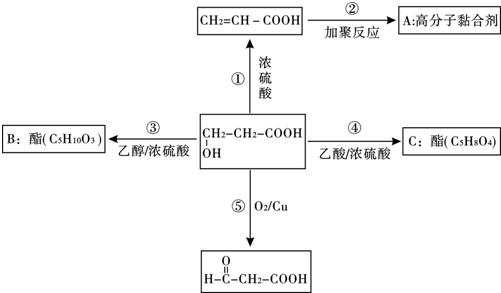
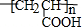 ,⑤2HOCH2CH2COOH+O2$→_{△}^{催化剂}$2OHCCH2COOH+2H2O.③的反应类型酯化反应或取代反应.
,⑤2HOCH2CH2COOH+O2$→_{△}^{催化剂}$2OHCCH2COOH+2H2O.③的反应类型酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com