
| A.加入NH4HSO4固体,v(H2)不变 |
| B.加入Na2SO4固体,v(H2)减小 |
| C.加入CH3COONa固体,v(H2)减小 |
| D.滴加少量CuSO4溶液,v(H2)减小 |
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2%H2O2溶液 | 无 |
| ② | 10mL5%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
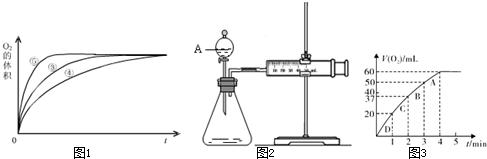
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| B.催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡 |
| C.向包有Na2O2的脱脂棉吹气后脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应 |
| D.强电解质水溶液的导电性一定大于弱电解质水溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲>乙 | B.甲<乙 | C.甲=乙 | D.无法确定 |
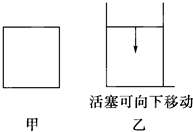
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增大煤炭燃烧时的燃烧热并形成清洁能源 |
| B.减少炉中杂质气体(如SO2等)的形成 |
| C.提高煤炭的热效率并减少CO的排放 |
| D.使得燃料燃烧充分,从而提高燃料的利用率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使用催化剂有利于加快合成氨反应的反应速率 |
| B.硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 |
| C.500℃左右比在室温时更有利于提高合成氨的转化率 |
| D.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com