

分析 由元素在周期表中位置,可知a为H,b为Na、c为Al、d为C、e为Si、f为N、g为O、h为Cl.
(1)H2O分子中氢原子与O原子之间形成1对共用电子对;常温下,钠与水反应生成氢氧化钠与氢气;
(2)元素金属性越强,最高价氧化物对应水化物的酸性越强;
(3)b的最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,该反应属于自发的氧化还原反应,可以作为设计原电池的反应原理.
解答 解:由元素在周期表中位置,可知a为H,b为Na、c为Al、d为C、e为Si、f为N、g为O、h为Cl.
(1)H2O分子中氢原子与O原子之间形成1对共用电子对,结构式为H-O-H;常温下,钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:H-O-H;2Na+2H2O=2Na++2OH-+H2↑;
(2)非金属性Si<C<N,元素金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:H2SiO3<H2CO3<HNO3,
故答案为:H2SiO3<H2CO3<HNO3;
(3)b的最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2H2O+2 OH-=2 AlO2-+3H2↑,该反应属于自发的氧化还原反应,可以作为设计原电池的反应原理,
故答案为:2Al+2H2O+2 OH-=2 AlO2-+3H2↑;能.
点评 本题考查元素周期表与元素周期律,注意整体把握元素周期表的结构,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( ) | 组别 | 对应曲线 | c(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度大于2.5 mol•L-1 | |
| C. | 第2组实验中盐酸的浓度等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度低于30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化 | |
| B. | 晶体中共价键的键长:金刚石中C-C<石墨中C-C | |
| C. | 晶体的熔点:金刚石<石墨 | |
| D. | 晶体中共价键的键角:金刚石>石墨. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
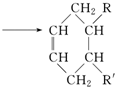 (可表示为
(可表示为 )其中,R、R′表示原子或原子团.
)其中,R、R′表示原子或原子团.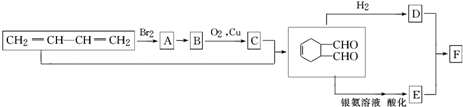
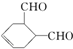 中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol
中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 两极材料 | Zn片、石墨 | Cu 片、Ag片 | Zn 片、Cu片 | Fe Cu |
| 插入溶液 | H2SO4溶液 | AgNO3溶液 | 蔗糖溶液 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量和核外电子数 | B. | 电子层数和最外层电子数 | ||
| C. | 相对原子质量和最外层电子数 | D. | 电子层数和次外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是物质的化学变化都伴随着能量的变化 | |
| B. | 凡是伴随能量变化的都是化学变化 | |
| C. | 凡是放热反应都需要加热 | |
| D. | 凡是放热反应都不需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com