

分析 向所得浊液中,逐滴加入1mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①0-10ml,随盐酸的体积增加,生成沉淀的质量不变,
说明A点沉淀是Mg(OH)2,m[Mg(OH)2]=0.87g,
NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-C点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥C点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液,然后结合方程式、原子守恒求出各个物理量.
解答 解:向所得浊液中,逐滴加入1mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①0-10ml,随盐酸的体积增加,生成沉淀的质量不变,
说明A点沉淀是Mg(OH)2,m[Mg(OH)2]=0.87g,
NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-C点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥C点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液.
(1)分析判断A处的沉淀为氢氧化镁,因为加入10.0mlHCl恰好中和过量的NaOH,再加HCl沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀为Mg(OH)2;
故答案为:A;
(2)10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓;
故答案为:H2O+AlO2-+H+=Al(OH)3↓;
(3)10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,则n(HCl)=0.02L×1mol/L=0.02mol,所以n(NaAlO2)=0.02mol,由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.02mol,氯化铝的质量=0.02mol×133.5g/mol=2.67g;
沉淀质量达到最大时,沉淀为Mg(OH)2和Al(OH)3,其质量为0.87g+0.02mol×78g=2.43g;
故答案为:2.67;2.43;
(4)30mL时,溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、MgCl2和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=$\frac{0.87g}{58g/mol}$×2+0.02mol×3+0.03L×1mol/L=0.12mol,
C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.12mol;C点所表示盐酸的体积为:V=$\frac{0.12mol}{1mol/L}$=0.12L=120mL,
答:C点时所用盐酸的体积120mL.
点评 本题考查了铝、镁及其化合物性质的分析判断,图象分析方法,对于图象分析题的解题规律:要明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=0.5mol/(L•s) | ||
| C. | v(C)=0.62mol/(L•s) | D. | v(B2)=90.0mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘氨酸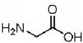 和硝基丙烷 CH3CH2CH2NO2互为同分异构体 和硝基丙烷 CH3CH2CH2NO2互为同分异构体 | |
| B. | 具有相同通式的两种有机物,要么互为同系物要么互为同分异构体 | |
| C. | C3H9N有四种 | |
| D. | 有机物中碳原子数一定时,烷烃中氢原子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
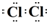 ,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
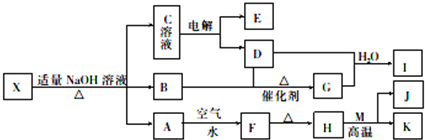
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
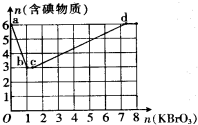 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:
近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁的电化学腐蚀和化学腐蚀往往同时发生 | |
| B. | 加入合适的催化剂,能降低反应活化能,从而改变反应的焓变 | |
| C. | 常温下,pH为5的氯化铵溶液和pH为9的醋酸钠溶液中水的电离程度不同 | |
| D. | 向BaSO4沉淀中加入饱和Na2CO3溶液后生成BaCO3,则Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com